Библиотека химических реакций (неорганика)
Текущая информация по разделам библиотеки:
Обновление за 06.05.05 (предыдущее 03.04.05) На сегодня у нас 1186 реакций. Из них:
ü необратимых реакций «=» – 1067
ü обратимых реакций (в том числе гидролиз, диссоциация) «ó» – 62
ü последовательно приводящих реакций«à» – 59
ü изображений реакций (объекты ISIS Draw) – 5
(Служебная информация:символы поиска: =, ó, à, -7 лишних символов)
Условные обозначения:
Данный радикал может быть любым галогеном, металлом, углеводородом: Hal, Me, R
Hет точных данных о продуктах реакции: A + B = C + …
Обрати внимание. Note Bene
Продолжительное проведение реакции: τ
Оглавление
v Азот.Оксиды. Аммиак. Кислоты. Соли 2
v Алюминий и его соединения 2
v Благородные газы 2
v Ванадий, Ниобий, Тантал и их соединения 2
v Бор. Борная кислота 2
v Вода и Пероксид водорода 2
v Водород 2
v Галогенов соединения. Кислоты 2
v Галогены 2
1. Фтор. 2
2. Хлор. 2
3. Бром.. 2
4. Йод. 2
v Германий, Олово, Свинец и их соединения 2
v Железо, Кобальт, Никель и их соединения 2
v Кислород. Озон 2
v Кремний. Оксиды. Силикаты. Силициды. Силаны 2
v Марганец. Перманганаты. Манганаты 2
v Медь, Серебро, Золото и их соединения 2
v Мышьяк, Сурьма, Висмут и их соединения 2
v Селен, Теллур и их соединения 2
v Семейство платины 2
v Сера. Сероводород. Сульфиды 2
v Серы оксид (IV). Сернистая кислота. Тиосульфат 2
v Серы оксид (VI). Серная кислота 2
v Скандий, Иттрий, Лантан и их соединения 2
v Титан, Цирконий, Гафний и их соединения 2
v Углерод. Оксиды. Карбонаты. Карбиды 2
v Фосфор. Фосфин. Галогениды. Кислоты. Соли 2
v Хром. Хромат. Дихромат. Молибден и вольфрам 2
v Цинк, Кадмий, Ртуть и их соединения 2
v Щелочные металлы 2
v Щелочноземельные металлы 2
Азот. Оксиды. Аммиак. Кислоты. Соли
ßНазад

N2+ 3H2 ó 2NH3
N2+ 6Li = 2Li3N + 39 кДж
NH4NO2(t°) = N2 + 2H2O
(NH4)2Cr2O7(t°) = N2 + Cr2O3 + 4H2O (горит как вулкан)
AlN + 4HCl = AlCl3 + NH4Cl
Ca3N2+ 6H2O = 3Ca(OH)2 + 2NH3 (часто нитриды щелочных и щелочноземельных металлов – бертоллиды)
Na3N + 3H2O = 3NaOH + NH3
Li3N + AlN (t°) = Li3AlN2
Li3N + BN (t°) = Li3BN2
NO3-+ 2H+ + 1e à NO2 + H2O
NO3-+ 4H+ + 3e à NO + 2H2O
2NO3-+ 10H+ + 8e à N2O + 5H2O
2NO3-+ 12H+ + 10e à N2 + 6H2O
NO3-+ 10H+ + 8e à NH4+ + 3H2O

3Cu + 2KNO3+ 4H2SO4 = 3CuSO4 + K2SO4+ 2NO + 4H2O
4NH3+ 5O2 (t°) = 4NO + 6H2O
HNO3 (раств) + Cu = NO + Cu(NO3)2+ H2O
2NO + Cl2(t°,h v) = 2NOCl (нитрозил-галогениды)
5NO + 3KMnO4+ 6H2SO4 = 5HNO3 + 3MnSO4 + 3KHSO4+ 2H2O
NO + 5CrCl2+ 4H2O = 5Cr(OH)Cl2 + NH3
NO + 3CrCl2+ 3HCl = NH2OH + 3CrCl3
2NO + SO2= N2O + SO3
Note Bene: [Cr(NH3)5NO]Cl2 [Fe(OH2)5NO]SO4 (часто NO группа – лиганд)

2NO+ O2(мгновенно окисляется) = 2NO2– бурый газ
2Cu(NO3)2(t°) = 2CuO + 4NO2 + O2
2N2O5ó 4NO2 + O2
NO2+ H2O + O2 = 2HNO3
3NO2+ H2O (t°) = 2HNO3 + NO – бесцветный газ
2NO2+ 2KOH = KNO3 + KNO2 + H2O
2NO2+ C = CO2 + 2NO
2NO2(г) (охлаждение) à N2O4(ж)
2NO2(г) + H2O ó HNO2 + HNO3 (растворение на холоде)
3NO2+ H2O (t°) = 2HNO3 + NO
4NO2+ 2H2O + O2 = 4HNO3 (применяют в промышленности)
NO2+ SO2 + H2O = H2SO4 + NO
NO2+ O3 à NO3 + O2
2NO3à O2NO ─ ONO2(N2O6)
N2O6+ 2H2O = 2HNO3 + H2O2
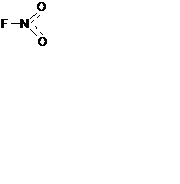
NO2+ F2 = 2NO2F
NaNO2+ F2 = NO2F + NaF

Нестабильная и стабильная форма
NO +NO2 (-t°) ó N2O3– синяя жидкость
N2O3+ H2O = 2HNO2
P2O3+ 2HNO3 = N2O3 + 2HPO3
N2O3+ Na2O = 2NaNO2
N2O3+ Ca(OH)2 = Ca(NO2)2 + H2O
Note Bene:  гипонитрат Na
гипонитрат Na
2HNO3+ P2O5 = 2HPO3 + N2O5 – прозрачные бесцветные кристаллы
N2O5 + H2O = 2HNO3
N2O5 + 2H2O2 (100%) = 2H ─ O ─ O ─ NO2 + H2O
H ─ O ─ O ─ NO2+ H2O = H2O2 + HNO3
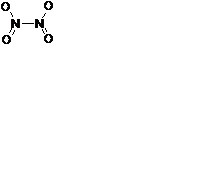
2NO2ó N2O4– бледно-желтая жидкость

NH4NO3 (t°) = N2O + 2H2O –бесцветный газ
5N2O + 8KMnO4 + 7H2SO4 = 3MnSO4 + 5Mn(NO3)2+ 4K2SO4 + 7H2O
2N2+ O2 (t°) = 2N2O
 Соли: первая форма – легкие металлы, вторая – тяжелые!
Соли: первая форма – легкие металлы, вторая – тяжелые!
2HNO2ó NO + NO2 + H2O (k = 6*10-4 при 25 °C)
AgNO2+ HCl = AgCl + HNO2
2HNO2+ 2HI =I2 + 2NO + 2H2O
HNO2+ H2O2 = HNO3 + H2O
3HNO2(τ) = HNO3 + 2NO + H2O
2HNO2+ H2S = 2H2O + S + 2NO
2NaNO2+ Na2S + 2H2SO4 = 2Na2SO4+ S + 2NO + 2H2O
5KNO2 + 2KMnO4 + 3H2SO4 = 5KNO3 + K2SO4+ 2MnSO4 + 3H2O
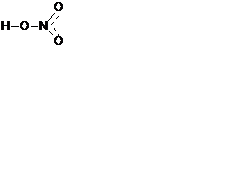
NaNO3+ H2SO4 (τ) = HNO3 + NaHSO4
8HNO3(разб) + 3Cu = 3Cu(NO3)2 + 2NO + 4H2O
2HNO3+ S = H2SO4 + 2NO
2HNO3(конц) + 6HCl ó3Cl2 + 2NO + 4H2O возможны варианты этой реакции:
HNO3(конц) + 3HCl = NOCl + Cl2 + 2H2O
4HNO3(hν) à4NO2 + 2H2O + O2 (частичное разложение HNO3)
4HNO3+ 3C = 3CO2 + 4NO + 2H2O
5HNO3+ 3P + 2H2O = 3H3PO4 + 5NO
8HNO3 (конц) + ZnS = ZnSO4 + 8NO2+ 4H2O
HNO3+ 3HCl + Au = AuCl3 + NO + 2H2O
HNO3+ 4HCl + Au = H[AuCl4] (золотохлороводородная к-та) + NO + 2H2O
MeNO3(t°) à до Mg à MeNO2 + O2
MeNO3(t°) à от Mg до Cu à MeO + NO2 + O2
MeNO3(t°) à после Cu à Me + NO2 + O2
2KNO3(t°) = 2KNO2 + O2
2KNO3+ 4H2SO4 + 3Cu = 3CuSO4 + K2SO4+ 2NO + 4H2O (нитраты способны растворять в кисл. среде металлы)
4LiNO3(t°) = 2Li2O + 4NO2 + O2 Еще одна реакция для лития…
AgNO3(t°) = Ag + NO2 + O2
Hg(NO3)2(t°) = Hg + 2NO2 + O2
2Cu(NO3)2(t°) = 2CuO + 4NO2 +O2

2NH3+ 3Br2 = N2 + 6HBr
NH3+ Na = NaNH2 + H0 (амид натрия)
2NH3+ 3CuO = 3Cu + N2 + 3H2O
2NH3+ H2O2 = N2 + 6H2O
4NH3+ 3O2 = 2N2 + 6H2O
4NH3+ 5O2 (Pt) = 4NO + 6H2O
NH3+ H2O ó NH4OH ó NH4+ + OH-
2NH3+ H2SO4 = (NH4)2SO4
2NH3+ NaOCl = N2H4 + NaCl + H2O
4NH3+ 3F2 = 3NH4F + NF3
2NF3+ 3H2O (пар, 7) = 6HF + NO + NO2
2NF3+ Cu = CuF2 + N2F4
NH4Cl + 3Cl2 = 4HCl + NCl3
2NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3
NH4NO2(t°) = N2 + 2H2O
NH4NO3(t°) = N2O + 2H2O
(NH4)3PO4(t°) = 3NH3 + H3PO4
(NH4)2SO4+ 2KOH = 2NH3 + K2SO4 + 2H2O
2KNH2+ Zn(NH2)2 = K2[Zn(NH2)4]
NaNH2+ N2O = NaN3 + H2O
3NaNH2+ NaNO3 = NaN3 + 3NaOH + NH3
 (молекула полярна)
(молекула полярна)
N2H4+ O2 (воздух) = N2 + 2H2O
N2H4+ 2I2 = N2 + 4HI
2N2H4+ 2Na = 2NaN2H3 + H2
NaN2H3+ H2O = NaOH + N2 + 2H2
Note Bene: N2H5Cl N2H6Cl2
HNO3+ 6H0 = NH2OH + 2H2O (крист., t°пл = 33°, 100 t° = взрыв!)
NH2OH + HCl = [NH3OH]Cl
NH2OH + HNO2 = [NH3OH]NO2
[NH3OH]NO2= N2O + 2H2O
2NH2OH + 2HI (при pH ~ 8) = I2+ N2H4 + 2H2O
2NH2OH + I2 (pH>9) = 2HI + N2 + 2H2O
 азотистоводородная кислота (~ pK уксусной кислоты)
азотистоводородная кислота (~ pK уксусной кислоты)
2HN3= H2 + 3N2 => в безводном состоянии взрывается от сотрясения и +t°
N2H4+ HNO2 = HN3 + 2H2O
HN3+ H2O (τ) = N2 + NH2OH
3HN3+ Cu = Cu(N3)2 + N2 + NH3
HN3+ 2HI = I2 + NH3 + N2
HN3+ 3HCl = 2Cl0 + N2 + NH4Cl
4HN3+ F2 = 4N2 + NH4F + FN3
AgN3+ Cl2 = AgCl + ClN3 + H2O
ClN3+ H2O ó HOCl + HN3
Note Bene: AgN3; Pb(N3)2; Hg(N3)2 – малорастворимые соли тяжелых металлов
NaN3; KN3 – растворимые и более устойчивые соли щелочных металлов
Pb(N3)2 – взрывается при ударе – детонатор
 азотноватистая кислота
азотноватистая кислота
Ag2N2O2 + 2HCl = 2AgCl +H2N2O2
H2N2O2 (t°) = N2O + H2O
3Na2N2O2(t°) = 2NaNO2 + 2N2 + 2H2O

Hg(ONC)2– ртутный детанатор

2HCN + 2K = 2KCN + H2
KCN + S = KCNS
 2020-08-05
2020-08-05 91
91







