ГЛАВА V
ОЧИСТКА РАСТВОРОВ СУЛЬФАТА ЦИНКА ОТ ПРИМЕСЕЙ
Технический прогресс в гидрометаллургическом производстве цинка тесно связан с совершенствованием методов очистки растворов сульфата цинка от примесей. Чистота растворов имеет весьма важное значение для технологии и экономики всего производства цинка.
При работе завода на чистых растворах увеличивается производительность гидрометаллургического оборудования, улучшаются процессы отстаивания и фильтрации пульп, повышается выход по току и снижается расход электроэнергии при электролизе цинка и, как следствие этих и других преимуществ работы на чистых растворах, снижается себестоимость производства цинка. Следует особо отметить значение чистоты растворов для улучшения условий труда в цехах электролиза и механизации сдирки катодного цинка.
Присутствующие в растворах примеси можно условно разделить в зависимости от способов очистки на следующие четыре группы;
I - железо, алюминий, мышьяк, сурьма, германий, индий, галлий, кремнезем.
II - медь, кадмий, кобальт, никель, таллий.
III - хлор, фтор.
IV -калий, натрий, магний, марганец.
Такое деление примесей на группы объясняется наличием у них некоторых сходных свойств, позволяющих применить один способ очистки для нескольких примесей. Так, например, от примесей I группы - железа, алюминия и пр. и частично от меди - растворы можно очистить при нейтрализации пульпы до определенного значения рН. Медь, кадмий, кобальт, никель и таллий удаляют из раствора методом цементации цинковой пылью, Для очистки от хлора и фтора приходится применять специальные реагенты, связывающие их в нерастворимые химические соединения. Последняя, IV группа накапливающихся примесей не поддается известным способам очистки, поэтому для понижения концентрации, в растворе калия, натрия, марганца и магния приходится обновлять баланс циркулирующих растворов путем вывода из процесса определенного объема растворов.
Исходя из наличия и свойств примесей, применяют гидролитическую очистку, метод цементации цинковой пылью, химические методы очистки, а также вывод из раствора накапливающихся примесей.
Гидролитическая очистка
Теоретические основы процесса гидролитической очистки
Гидролитическая очистка раствора сульфата цинка от примесей основана на гидролизе и осаждении примесей в виде гидроокисей при нейтрализации пульпы или раствора и уменьшении в них концентрации ионов водорода. Показателем концентрации водородных ионов служит рН. Д. М. Чижиков приводит следующие значения рН и соответствующую им кислотность для растворов цинкового производства:
| рН....... | 7 | 6 | 5 | 4 | 3 | 2 | 1 | 0 |
| HaSO4, мг/л. | Вода | 0,05 | 0,5 | 5,0 | 50 | 500 | 5000 | 75 000 |
Следует отметить, что при помощи этого метода удаляют только те примеси, которые выпадают в осадок при значениях рН меньших, чем для гидроокиси цинка.
Осаждение различных гидроокисей происходит по достижении определенного рН, который в свою очередь зависит от концентрации катиона и температуры. Наиболее полные исследования гидролиза солей тяжелых металлов проведены Б. В. Громовым. В табл. 14 приведены установленные им равновесные значения рН осаждения гидроокисей металлов.
Таблица 14
Равновесные значения рН осаждения гидроокисей по Б. В. Громову
| Гидроокиси металлов | рН | Начало осаждения при данной концентрации | |
| г/л | рН | ||
| Железо окисное….. | Ниже 3,0 | 2,0 | 1,7 |
| Алюминий.............. | 3,26-4,43 | 1,0 | 4,0 |
| Медь........................ | 3,80-6,02 | 2,0 | 4,4 |
| * | 0,5 | 5,5 | |
| Цинк....... ……. | 5,25-7,20 | 100-120 | 5,6 |
| Кадмий.................... | 5,65-8,00 | 0,3 | 7,5 |
| Железо закисное…. | 6,46-8,50 | 0,5 | 8,5 |
| Кобальт.................... | 6,60-8,50 | 0,05 | 8,5 |
| Марганец (II).......... | Выше 8,60 | 5,0 | 9,0 |
Из данных табл. 14 следует, что из раствора сульфата цинка с концентрацией катиона 100-200 г/л можно удалить гидролизом только те примеси (приведенные в таблице), которые имеют рН осаждения гидроокиси ниже 5,5-5,6, т. е. железо окисное, алюминий и медь. С повышением концентрации металла в растворе рН начала осаждения его гидроокиси снижается. Эта зависимость представлена на рис. 59. Регулируя рН пульпы в процессе нейтрального выщелачивания огарка, возгонов или при нейтрализации раствора, можно осаждать посредством гидролиза полностью или частично те или иные примеси. Для управления процессом гидролитической очистки необходимо знать поведение каждой из примесей.
Поведение железа и алюминия. Железо практически всегда находится в растворах сульфата цинка в различных количествах (1- 2 г/л) в форме сульфата закиси FeSО4 и сульфата окиси Fe2(SO4)3. Так как при выщелачивании огарка или возгонов в пульпе имеются восстановители, то в кислом растворе концентрация трехвалентного железа обычно меньше, чем двухвалентного.
При соответствующих условиях соединения железа гидролизуют по реакциям:
FeSO4 + 2Н2О ↔ Fe (ОН)2 + Н3SO4; (44)
Fe2 (SO4)3 + 6Н3О ↔ 2Fe (ОН)3+ ЗН2 SO4. (45)
В действительности же, в условиях выщелачивания огарка пли окиси цинка происходит осаждение основных сульфатов железа типа Fe (OH)·S04. Гидроокиси в чистом виде осаждаются лишь из очень разбавленных растворов.
Как следует из табл. 14, закисное железо при обычных значениях рН в нейтральной ветви (5,4-5,6) гидролизовать не будет, так как гидролиз его начинается только при рН = 6,46. Поэтому для полноты удаления из раствора двухвалентное железо необходимо перевести в трехвалентное, которое начинает гидролизовать при более низких значениях рН (например, при концентрации 2 г/л при рН=1,7).
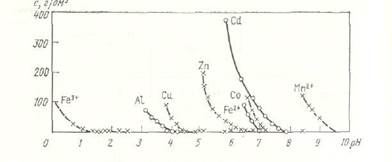
Рис. 59. Влияние концентрации катиона в растворе с на рН осаждения его гидроокиси
Окисление двухвалентного железа можно осуществлять, используя высшие соединения марганца, кислород воздуха и соединения меди. В первом случае используют тонкоизмельченную марганцевую руду (пиролюзит), перманганат калия или шлам электролизных ванн, содержащий МnО2. Окисление закисного железа соединениями марганца протекает по реакциям
2FeSO4 + МnО2 + 2H2SO4 = Fe2 (SO4)3 + MnSO4 + 2H2O; (46)
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2 (SO4)3 + K2SO4 + 2MnSO4 + 8H2O. (47)
Эти реакции протекают успешно в кислой среде при кислотности не менее 5-10 г/л H2SO4 и температуре 50-60° С. Поэтому марганцевую руду и шлам электролизных ванн чаще применяют для окисления железа в растворах от выщелачивания пылей и возгонов в цехах, где их перерабатывают, или перед направлением в основной рудный цикл. Для этого растворы пылевого цикла пропускают через специальный, так называемый окислительный пачук, куда подают в расчетном количестве марганцевую руду или шлам и отработанный электролит.
Ионы двухвалентного железа могут окисляться также кислородом воздуха, но в отличие от предыдущего способа процесс окисления воздухом протекает быстрее в нейтральной среде. При этом получают кристаллические осадки гидроокиси и основных сульфатов железа, которые сравнительно легко фильтруются. Теоретически метод окисления кислородом воздуха обоснован исследованиями ВНИИцветмета. Согласно этим исследованиям, в кислой среде при рН<3 реакция идет очень медленно. С повышением рН до 5,6-5,2 сульфат окиси железа Fe2(SO4)3 гидролизует с образованием малорастворимой гидроокиси, выпадающей из раствора в осадок, что и служит ускоряющим фактором.
В присутствии катализаторов (ионы меди и др.) реакция окисления закисного железа кислородом воздуха протекает с большей скоростью. Кислород воздуха пригоден и для окисления других неорганических восстановителей, присутствующих в растворах сульфата цинка. Однако для окисления органических соединений он неприменим. Для их разрушения необходимо использовать пиролюзит или другие более сильные окислители.
Работами ВНИИцветмета установлена также практическая возможность использования двухвалентных ионов меди в качестве окислителя для закисного железа. Взаимодействие ионов железа и меди можно представить в следующем виде:
Fe2+ + Cu2+ ↔ Fe3+ + Cu+ (48)
При рН>2,5, что имеет место при нейтральном выщелачивании, эта реакция идет слева направо, т.е. в сторону окисления закисного железа ионами двухвалентной меди. При рН<2,5 реакция идет в обратном направлении, в сторону восстановления окисного железа.
Различное направление реакции объясняется изменением величины окислительно-восстановительного потенциала систем Fe2+/Fe3+ и Cu2+/Cu+ при изменении рН среды и образованием вследствие этого твердых фаз при нейтрализации раствора. Зависимость потенциалов указанных систем от рН среды представлена на рис. 60.
При двухстадийной схеме выщелачивания огарка (первая - нейтральная, вторая - кислая стадии) эффект от реакции окисления закисного железа ионами меди обычно отсутствует ввиду того, что осадок одновалентной меди, образующийся при окислении железа в нейтральной ветви, начинает действовать как восстановитель при довыщелачивании сгущенной нейтральной пульпы в кислой ветви, вновь восстанавливая трехвалентное железо. Эффект этой реакции может быть использован более полно при одностадийной схеме выщелачивания огарка как для окисления железа, так и для уменьшения расхода цинковой пыли на осаждение меди из раствора.
При гидролизе сульфата окиси железа и осаждении гидроокиси или основных сульфатов железа получают объемистые осадки, затрудняющие процессы отстаивания и фильтрации. Поэтому содержание железа в растворах от выщелачивания огарка стремятся не допускать более 1,5-2 г/л. Вместе с тем концентрация железа должна быть достаточной для обеспечения очистки раствора от мышьяка, сурьмы и германия.
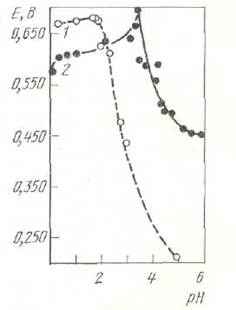
Рис. 60. Изменение окислительных потенциалов Е железа и меди с повышением рН среды: 1- Fe3+/Fe2+; 2 – Cu2+/Cu+
Поведение алюминия при гидролитической очистке растворов практически не отличается от поведения трехвалентного железа. Как показано в табл. 14, гидролиз сульфата алюминия происходит в пределах рН = 3,26÷4,43. В результате гидролиза образуется гидроокись алюминия, которая выпадает в осадок.
Поведение меди. Поведение меди при нейтрализации цинкового раствора имеет весьма важное значение для понимания всего процесса гидролитической очистки раствора и управления режимом нейтрального выщелачивания. Находящийся в растворах от выщелачивания огарка сульфат меди гидролизует по реакции
CuSO4 + 2Н3О ↔ Си (ОН)2 + H2SO4. (49)
Не исключено при этом и получение основного сульфата.
Образование осадка гидроокиси меди начинается при рН = 3,8 и ускоряется при более высоких его значениях. Как установлено исследованиями ВНИИцветмета, в отличие от трехвалентного железа реакция гидролитического осаждения меди в условиях нейтрального выщелачивания протекает медленно и не полностью. Малая скорость реакции приводит к растягиванию процесса гидролиза меди по всей ветви нейтрального выщелачивания, включая сгустители.
При неблагоприятных условиях нейтрального выщелачивания (недостаток нейтрализующего вещества, низкая его реакционная способность вследствие большой крупности и плохой контакт с раствором)скорость гидролиза меди намного превышает скорость се осаждения и продолжающийся в сгустителях гидролиз меди с выделением серной кислоты по существу определяет рН пульпы и тем1 самым ухудшает гидролитическую очистку раствора от других примесей (мышьяка, сурьмы, германия). Насколько сильно влияет остаточное содержание меди на рН раствора с концентрацией цинка 120 г/л видно из следующих данных:
| Содержание меди, г/л………. | - | 0,1 | 0,5 | 1,0 | 2,0 |
| рН раствора….. | 5,08 | 5,01 | 4,9 | 4,85 | 4,68 |
| Содержание меди, г/л………. | 3,0 | 4,0 | 5,0 | 6,0 |
| рН раствора….. | 4,47 | 4,32 | 4,20 | 4,01 |
В результате проведенных исследований удалось также выяснить, что из-за близости равновесных значений рН для меди и цинка торможение процесса гидролитического осаждения меди связано с повышением концентрации ионов водорода в растворе вследствие гидролиза сульфата цинка. Поэтому чем выше концентрация цинка в растворе, тем ниже степень осаждения меди. Так, при повышении концентрации цинка в растворе со 100 до 150 г/л степень осаждения меди снижается в 1,5 раза.
В ряде случаев добиться высокого рН раствора без предварительного осаждения части меди практически невозможно. Это обстоятельство затрудняет переработку цинковых концентратов с повышенным содержанием меди.
Применение для нейтрализации пульпы тонких фракций огарка (-0,15 мм), достаточный его избыток и увеличение продолжительности нейтрального выщелачивания способствуют ускорению реакций гидролитического осаждения меди до остаточного содержания ее в растворе 0,2 г/л. Положительное влияние оказывает и присутствие в растворе ионов двухвалентного железа. Как указывалось выше, при взаимодействии этих ионов с ионами двухвалентной меди происходит восстановление последних до одновалентных. Образующийся при этом сульфат закиси меди Cu2SO4 гидролизует практически мгновенно при более низких значениях рН, чем сульфат окиси CuSO4 Наиболее полно осаждение происходит при соотношении концентраций железа и меди, равном 0,8-1,0.
Поведение мышьяка и сурьмы. Сернокислые соединения мышьяка и сурьмы при нейтрализации раствора окисью цинка также гидролизуют. Реакции гидролиза можно представить в следующем виде:
As2 (SO4)3 + 3ZnO + ЗН2О = As2 O3 ·3H2O + 3ZnSO4; (50)
Sba2(SO4)3 + 3ZnO + 3H2O = Sb3O3 ·3H2O + 3ZnS O4. (51)
Гидролитическое осаждение этих примесей идет тем лучше, чем выше степень их валентности.
Исследованиями Гинцветмета и других организаций установлено, что, помимо гидролиза сернокислых солей мышьяка и сурьмы, протекающего при нейтрализации раствора и повышении рН, имеют место и другие реакции, которые главным образом и обеспечивают необходимую степень очистки растворов от этих примесей. Согласно результатам исследований мышьяк образует с цинком, кадмием, медью и железом химические соединения - арсениты и арсенаты. Так, при взаимодействии мышьяка с железом1 по реакции
Fe2 (SO4)3 + 2H3AsО4 = 2FeAsO4 + 3H2SO4 (52)
образуется арсенат железа - наименее растворимое и легко фильтруемое соединение. Благодаря этому при больших концентрациях мышьяка он может быть осажден при низких (менее 1,8-2,0) значениях рН.
Осаждение проходит успешнее, когда и мышьяк, и железо имеют наивысшую валентность. В некоторых случаях мышьяк может быть осажден в виде арсенитов и арсенатов цинка. Полнота осаждения мышьяка в конечном счете зависит от его исходной концентрации, температуры н рН раствора.
В процессе нейтрализации пульпы при рН=2,0÷4,3 в присутствии железа происходит и осаждение трехвалентной сурьмы с окисным железом. В осадок переходят основные сульфаты железа и сурьмы в различных соотношениях. Пятивалентная сурьма удаляется из раствора адсорбцией на основном сульфате окиси железа. Процесс осаждения идет примерно по следующей схеме: осаждение сульфата железа - адсорбция сурьмы на поверхности сульфата железа - образование антимоната железа.
Для соосаждения мышьяка и сурьмы с железом необходимо иметь в растворе определенный избыток ионов железа. Практические данные показывают, что для полного осаждения мышьяка требуется десятикратный, а для сурьмы двадцатикратный избыток ионов железа в растворе. Осаждение пятивалентных соединений этих металлов, как правило, проходит полнее и требует меньшего избытка железа. Так, пятивалентная сурьма осаждается почти нацело при отношении ж:т =10:1,а трехвалентная форма ее - только при соотношении 20:1.
При выщелачивании цинкового огарка находящегося в растворе железа бывает достаточно для успешного осаждения мышьяка и
сурьмы. Более трудной задачей является очистка от этих примесей растворов, полученных от выщелачивания вельц - окислов и возгони в которых содержание мышьяка и сурьмы намного выше, a концентрация железа мала. Гидролитическая очистка этих раствора осложняется еще и тем, что в возгонах обычно присутствует значительное количество органических и неорганических восстановителей, препятствующих переводу мышьяка и сурьмы в высшую форму валентности.
Для успешного проведения гидролитической очистки растворов пылевого цикла от мышьяка и сурьмы необходимо разрушить органические и окислить неорганические восстановители, перевести соединения мышьяка и сурьмы в высшие формы валентности, а также обеспечить необходимое соотношение ионов железа и этих примесей. С этой целью используют указанные выше окислители: марганцевую руду, воздух, соединения меди.
Первые годы работы цинковых заводов на переделе выщелачивания возгонов показали, что без наличия в растворах определенного количества ионов меди окисление органических и неорганических восстановителей, суммарное содержание которых в пересчете на двухвалентное железо достигает иногда 4-5 г/л, протекает очень медленно даже при большом расходе марганцевой руды. Поэтому в настоящее время в пульпу при выщелачивании возгонов тем или иным способом вводят соединения меди, концентрацию которой на кислой ступени выщелачивания поддерживают в пределах 3-4 г/л, а при нейтрализации раствора и доводке рН до заданной величины - не менее 0,5 г/л.
В связи с недостатком в растворах пылевого цикла железа его вводят извне различными методами, растворяя в отработанном электролите железный скрап, цинковые кеки или добавляя железный купорос. Получила также распространение практика возврата в голову процесса выщелачивания железистых илов, содержащих гидроокись железа.
Особенность гидролитической очистки растворов пылевого цикла от мышьяка и сурьмы заключается и в том, что для нее требуется более высокая температура (65-70°С), которая позволяет ускорить процесс гидролиза и осаждения примесей.
Поведение германия, индия, галлия и теллура. Эти элементы также удаляются из раствора в процессе гидролитической очистки. Осаждение их происходит в присутствии железа, но механизм осаждения изучен недостаточно. Принято считать, что германий адсорбируется основными сульфатами железа. Адсорбция имеет место при рН>2,5. При повышенных содержаниях германия в растворах, например при переработке возгонов, полностью удалить его за одну операцию нейтрального выщелачивания не удастся. В этом случае проводят повторную, более глубокую гидролитическую очистку.
Поведение индия аналогично поведению железа. Полного осаждения индия добиваются при нейтрализации раствора до рН=4,8÷5,0. Так как индий является весьма ценным компонентом, то для извлечения этого металла при переработке возгонов или цинковых кеков при промышленных содержаниях его в растворе гидролитическое осаждение ведут таким образом, чтобы отделить осадок индия от основной массы гидроокиси и основных сульфатов железа. Сделать это можно двумя путями. Первый способ заключается в том, что вначале осаждают совместно при нейтральном выщелачивании железо и индий. Осадок подвергают затем кислому выщелачиванию с целью перевода индия в раствор и последующего его гидролитического осаждения в гидратный продукт с меньшим содержанием железа. Другим способом можно, не окисляя основного количества железа в кислом растворе и проводя его нейтрализацию, осадить индий в гидратный осадок с относительно небольшим содержанием железа, при рН меньшем, чем равновесное значение для гидролиза двухвалентного железа - 4,8 -5,2.
Поведение кремниевой кислоты. Повышение рН в процессе нейтрализации пульпы приводит не только к гидролитическому осаждению ряда примесей, но и к коагуляции кремниевой кислоты, т. е. переводу золя в гель и укрупнению коллоидных частиц. Начало коагуляции зависит от концентрации кремниевой кислоты в кислом растворе. По данным Гинцветмета, гель кремниевой кислоты в цинковых растворах образуется при следующих минимальных значениях рН (начало коагуляции):
| Содержание | ||||
| SiO2, г/л....... | 12,0 | 8,0 | 2,0-2,5 | 1,0-2,0 |
| рН.......... | 3,5-3,6 | 4,1-4,2 | 4,7-4,8 | 5,0-5,1 |
При нейтрализации раствора до рН = 5,1÷5,2 в нем всегда остается около 0,2 г/л кремниевой кислоты, независимо от ее исходной концентрации.
Если нейтрализация вследствие ряда причин (недостаточный избыток нейтрализующего вещества, малая продолжительность операции) проведена недостаточно полно и кремниевая кислота осталась в растворе в больших количествах, то она выпадает затем на фильтровальной ткани при последующей очистке раствора цинковой пылью, что вызывает иногда полное прекращение фильтрации. Объясняется это некоторым повышением рН раствора в процессе цементации примесей цинковой пылью.
Коагуляция кремниевой кислоты способствует ускорению осаждения из раствора таких металлов, как железо, медь, мышьяк и сурьма в виде гидроокисей. Из графика, приведенного на рис. 35, следует, что при нейтрализации раствора в течение 6 мин одновременно с уменьшением концентрации кремниевой кислоты в растворе с 4,65 до 0,21 г/л резко снижается содержание железа - с 0,53 до 0,2 г/л, меди - с 1128 до 630 мг/л, мышьяка - с 14,1 до 0,15 мг/л и сурьмы - с 1,8 до 0,1 мг/л. По-видимому, в момент укрупнения коллоидных частиц кремниевой кислоты и их коагуляции последние увлекают из растворов и мельчайшие частицы гидроокисей металлов.
Суммируя сказанное выше, можно сделать вывод, что для успешной гидролитической очистки цинковых растворов от примесей необходимы следующие условия:
1. Достаточно высокое значение рН, обеспечивающее возможно более полное осаждение гидроокисей металлов и кремнекислоты. Однако это значение рН не должно превышать 5,4-5,6 (в зависимости от концентрации цинка), когда начинается гидролиз сульфата цинка.
2. Применение тонкой фракции огарка (-0,15 мм) или возгонов (лучше в виде пульпы) в необходимом избытке для ускорения нейтрализации кислоты.
3. Продолжительность операции перемешивания раствора с нейтрализующим веществом, достаточная для' полного протекания реакции гидролитического осаждения. При несоблюдении данного условия гидролиз будет продолжаться в значительной мере при сгущении и отстаивании пульпы.
4. Предварительное разрушение или окисление органических и неорганических восстановителей с помощью соединений марганца и меди высшей валентности.
5. Предварительное или одновременное с нейтрале задней раствора окисление железа, мышьяка и сурьмы различными методами до высшей валентности.
6. Использование окислителей в соответствующих условиях: марганцевой руды в кислой среде, воздуха и соединений меди в нейтральной, при рН>3.
7. Обеспечение в растворе необходимого соотношения железа, мышьяка и сурьмы для полного осаждения последних.
8. Подогрев до 75-80° С при гидролитической очистке растворов пылевого цикла.
Поведение гидроокисей металлов и кремнекислоты при взаимодействий с серной кислотой. Осаждение гидратов окисей железа, меди, мышьяка, сурьмы, кремневой кислоты при нейтральном выщелачивании огарка или возгонов еще не означает полного вывода этих примесей из технологического процесса. При нейтрализации раствора в результате гидролитической очистки они переходят в твердые продукты - цинковые, свинцовые и железистые осадки. Однако по многим технологическим схемам эти продукты вновь подвергаются обработке серной кислотой в кислой ветви или при операции до-выщелачивания из них цинка.
Под действием серной кислоты осажденные ранее примеси частично вновь переходят в раствор в той или иной степени, что вызывает циркуляцию их в процессе. Вследствие избирательного свойства серной кислоты, особенно при низкой ее концентрации, растворяется преимущественно окись цинка, а полного обратного растворения осажденных примесей обычно не наблюдается. Этим обеспечивается вывод примесей с цинковыми кеками.
Обратное растворение гидроокисей металлов в кислой ветви зависит от продолжительности выщелачивания осадка, особенно от кислотности растворителя. Легче всего растворяются гидраты окиси меди, затем соединения мышьяка, железа и кремниевой кислоты. Следовательно, для того чтобы уменьшить циркуляцию и накопление этих примесей в процессе и обеспечить наиболее полный вывод их из цикла выщелачивания, необходимо применять в кислой ветви минимальную кислотность. Радикальным решением этого вопроса является переход к одностопной схеме выщелачивания, исключающей какое-либо накопление этих примесей в процессе.
Практика гидролитической очистки
Многолетний опыт работы отечественных цинковых заводов свидетельствует о том, что при выщелачивании только в отработанном электролите расчетного (с некоторым избытком) количества цинкового огарка на кислой ступени в растворе обнаруживается сравнительно небольшое количество примесей. Так, при нейтрализации отработанного электролита Усть - Каменогорского свинцово-цинкового комбината с кислотностью 120 г/л H2SO4 огарком с 10%-ным избытком в растворе было найдено 7,2 г/л H2SO4; 1128 мг/л Сu; 528 мг/л Feобщ; 4,65 г/л SiO2; 14,1 мг/л As; 1,8 мг/л Sb.
При одностадийном нейтральном выщелачивании гидролитическая очистка и вывод из процесса таких примесей, как железо, медь (частично), мышьяк, сурьма, кремнезем в указанных выше концентрациях, не представляют трудностей, так как все осажденные гидроокиси перейдут в цинковый кек и будут выведены из производственного цикла. Однако из-за больших потерь цинка одностадийное нейтральное выщелачивание в чистом виде практически нигде не применяют. Поэтому при довыщелачивании в серной кислоте сгущенной нейтральной пульпы (цинкового кека) осажденные примеси вновь частично переходят в раствор и начинают циркулировать между нейтральной и кислой ветвями.
Такая циркуляция приводит к накапливанию примесей в производственном цикле и увеличению содержания их в растворах. Это накапливание и повышение концентрации происходит до тех пор, пока не установится равновесие между количеством примесей, переходящих в раствор из огарка, и количеством примесей, выводимых из процесса с цинковыми кеками на кислой стадии. Кроме того, в голову нейтрального выщелачивания поступают различные фильтраты и оборотные растворы как цинкового, так и смежных - кадмиевого и редкометального - производств, также содержащие большое количество примесей.
В связи с указанным содержанием примесей в оборотном кислом сливе возрастает в несколько раз и достигает в рудном цикле: 2,5-3 г/л Сu; 1,5-2 г/л Feобщ; 40—80 мг/л As; 10 и более мг/л Sb.
Таким образом, нейтральная ветвь выщелачивания должна обеспечивать гидролитическую очистку значительно большего количества примесей, чем то количество, которое переходит в раствор из огарка.
Исходя из этого технологи особое внимание уделяют кислой стадии выщелачивания или довыщелачивания как главному поставщику примесей, стремясь, с одной стороны, обеспечить заданное извлечение цинка в paствор, а с другой, предотвратить по возможности большой переход в раствор осажденных примесей. Если соотношение огарка и отработанного электролита выдерживается согласно технологии, а количество оборудования достаточно для извлечения цинка в раствор в заданном количестве, то основной задачей является обеспечение гидролитической очистки растворов.
В зависимости от качества цинковых концентратов и принятой технологической схемы кислотность пульпы на кислой стадии выщелачивания при непрерывном процессе устанавливают от 2-5 г/л в головном и до 0,5-1,5 г/л в последнем реакторе, а при периодическом процессе остаточную кислотность принимают в пределах рН = 2÷3. Такой кислотный режим обеспечивает минимальное содержание примесей в верхнем сливе кислых или промывочных сгустителей. При возрастании концентрации примесей в кислом сливе кислотность пульпы снижают.
Важнейшее значение при гидролитической очистке растворов от примесей имеет величина рН. Заданная величина рН, проверенная ранее опытным путем, должна соблюдаться не только в реакторах нейтрального выщелачивания, но и в каждом из нейтральных сгустителей, поскольку в сгустителях во многих случаях продолжается гидролиз различных сульфатов. Нарушение кислотного режима хотя бы в одном сгустителе влечет за собой ухудшение качества всех растворов, так как последние из сгустителей сливаются в общий коллектор.
Величина рН при нейтральном выщелачивании в зависимости от характера сырья колеблется в широких пределах. Для обеспечения полноты очистки растворов нейтрализация должна заканчиваться, а пульпа выдерживаться определенное время при рН = 4,8÷5,4. Для обеспечения полного гидролиза примесей эти значения должны быть достигнуты как можно быстрее, так как растягивание процесса нейтрализации приводит к ухудшению физических свойств пульпы, в частности отстаивания и фильтрации.
Ускорить процесс нейтрализации можно или увеличением избытка огарка или использованием обожженного материала с большей, чем обычно, реакционной способностью. В первом случае при ограниченной мощности гидрометаллургического оборудования дополнительное количество огарка может привести к перегрузке аппаратуры и некоторому снижению извлечения; цинка. Поэтому предпочтительнее второй путь. На рис. 26 показано, что тонкие фракции огарка обладают более высокой реакционной способностью и позволяют достигать максимального рН раствора в считанные минуты. Этим материалом и следует пользоваться для доводки пульпы до нужного рН. Дополнительным показателем степени гидролиза при нейтральном выщелачивании служит содержание меди в готовой к сгущению пульпе, так как гидролиз меди протекает при значениях рН, близких к рН нейтральной пульпы.
На одном из заводов с непрерывным способом выщелачивания в соответствии с технологической инструкцией степень гидролитического осаждения меди в нейтральной ветви составляет 70-75% от ее содержания в верхнем сливе кислых сгустителей, а концентрация меди в растворах нейтральной ветви 1000-1800 мг/л. На этом же предприятии равномерность распределения нейтральной пульпы по сгустителям контролируют по содержанию меди в верхнем сливе, которое не должно различаться по сгустителям более чем на 200 мг/л.
Если содержание меди в сливе сгустителя больше установленного, гидролиз примесей идет плохо и очистка от железа, мышьяка, сурьмы будет неполной. Снижения концентрации меди добиваются путем увеличения подачи в сгуститель нейтральной пульпы и некоторой задержки в выпуске нижнего продукта. При меньшем против заданного содержания меди стараются быстрее обновить содержимое сгустителя. Для этого одновременно увеличивают и подачу пульпы, и выпуск из него нижнего слива.
Успех гидролитической очистки растворов от железа, мышьяка, сурьмы и германия во многом зависит от количества и степени окисления железа перед его нейтрализацией. Там, где мышьяка и сурьмы в растворах сравнительно мало, а железа и меди достаточно, окисление железа осуществляют кислородом воздуха в присутствии меди в нейтральной среде. При больших содержаниях в растворах мышьяка и сурьмы концентрации железа оказывается недостаточно и его приходится вводить в процесс в виде железного купороса, приготовленного из скрапа или растворением в серной кислоте цинкового кека.
Особое внимание при этом обращают на окисление железа в растворах, поступающих из пылевого цикла, содержащих обычно большое количество примесей (100-200 мг/л мышьяка, 15-20 мг/л сурьмы). В ряде случаев такие растворы приходится подвергать окислению дважды - вначале в специальном окислительном пачуке, с применением марганцевой руды или шлама электролизных ванн, затем вместе с верхним сливом кислых сгустителей - и только после этого направлять в нейтральную ветвь.
Как уже говорилось выше, количество железа в растворе должно быть достаточным для обеспечения соосаждения при его гидролизе мышьяка и сурьмы, а степень окисления двухвалентного железа должна быть такой, чтобы концентрация закисной формы не превышала 30-50 мг/л. При больших содержаниях железа окислить его воздухом в присутствии ионов меди в нейтральной среде не всегда удается. Поэтому приходится процесс нейтрального выщелачивания при периодическом способе искусственно разрывать для того, чтобы на кислой ступени окислить марганцевой рудой, а затем осуществить гидролиз в нейтральной среде.
В результате соблюдения заданного технологического режима на большинстве отечественных цинковых заводов гидролитическая очистка растворов, в том числе поступающих из пылевого цикла, обеспечивает удаление примесей при нейтральном выщелачивании огарка и сгущении пульпы до следующих концентраций: 30- 50 мг/л Fe, 0,5-1,5 г/л Сu, 0,2-0,6 мг/л As, 0,2- 0,6 мг/л Sb, 0,2 мг/л Ge.
Более сложной является гидролитическая очистка цинковых растворов от выщелачивания возгонов. Объясняется это прежде всего повышенным против рудного цикла содержанием в них мышьяка, сурьмы и германия. Обычно при переработке вельц - окислов и шлаковозгонов концентрация мышьяка достигает 200 мг/л, сурьмы 25-30 мг/л. В том случае, когда в производство в большом количестве вовлекаются свинцовые пыли для извлечения редких металлов, содержание мышьяка и сурьмы повышается соответственно до 500-1000 и 80-130 мг/л.
В то же время растворы от выщелачивания возгонов содержат очень мало меди и железа, т. е, тех компонентов, которые необходимы для окисления и осаждения мышьяка, сурьмы и германия. Вследствие этого на большинстве отечественных заводов не проводят в пылевом цикле глубокой гидролитической очистки, после которой растворы можно очищать цинковой пылью, а предпочитают направлять эти растворы на доочистку в рудный цикл.
В связи с различием в характере сырья предприятия по-разному проводят гидролитическую очистку растворов. Однако общепризнанно, что без введения в пылевой цикл нужного количества меди и железа получить хороших результатов нельзя. На тех заводах, где удельный вес окисленного сырья в балансе производства велик, как, например, на «Электроцинке», глубокую гидролитическую очистку растворов всего пылевого цикла осуществляют в непрерывном режиме в трех последовательных пачуках и сгустителе для отстаивания. В рудный цикл здесь направляют (смешивают с кислым сливом сгустителей и подают на смыв огарка) слив сгустителя гидролитической очистки с содержанием, мг/л: 50-100 Fe; 0,5-1,0 Sb; 0,1 Ge.
На предприятиях, где возгонов перерабатывают относительно мало (Челябинский завод), проводят по существу только одну гидролитическую очистку с передачей в рудный цикл растворов с повышенным содержанием мышьяка и сурьмы - 40 и 25 мг/л соответственно. По этим причинам наиболее тщательно с применением известкового молока приходится проводить глубокую гидролитическую очистку на заводе «Укрцинк», где растворы очищают до остаточного содержания мышьяка 0,2 мг/л и сурьмы 0,5 мг/л. В качестве окислителя большинство предприятий использует кислород воздуха, осуществляя процесс окисления в нейтральной среде в присутствии ионов меди не менее 0,5 г/л.
 2020-08-05
2020-08-05 991
991







