СПИРТЫ
Спирты – это производные углеводов, в которых один или несколько атомов водорода заменены на гидроксильные группы. В зависимости от числа гидроксильных групп спирты подразделяются на одно-, двух-, трехатомные и др., а в зависимости от характера углеводородного радикала – на алифатические, ациклические и ароматические; первичные, вторичные и третичные спирты.
К лекарственным веществам группы алифатических спиртов относятся спирт этиловый и глицерол (глицерин).
В ряду спиртов существуют некоторые закономерности и взаимосвязи.
Связь химической структуры спиртов и фармакологического действия:
1. введение спиртового гидроксила в молекулу любого фармакологически-активного соединения ослабляет его токсичность и усиливает (в случае низкомолекулярных соединений) наркотический характер;
2. увеличение числа гидроксильных групп снижает токсичность спиртов. Например: метанол – глицерин – манит.
На физиологическую активность спиртов оказывает влияние следующие факторы:
1. длина углеродной цепи: очень токсичен метиловый спирт, у спиртов, содержащих более 6 атомов углерода, токсичность снижается и практически отсутствует у спиртов с цепочкой углеродов из 16 атомов, но дальнейшее увеличение цепи ведет к снижению активности и токсичности, что связано с изменением растворимости, а, следовательно, и всасываемости. 16 С содержащий спирт инертен;
2. разветвление цепи ведет к усилению физиологической активности (н аркотической);
3. введение в молекулу спирта галогена или образование непредельных связей повышает наркотическую активность.
Физические свойства
Связь химической структуры спиртов и физическими свойствами:
1. Низкомолекулярные одноатомные спирты, например, этиловый, - это очень легко растворимые в воде легкокипящие жидкости. Удлинение углеродной цепи приводит к уменьшению растворимости. Этанол и глицерин смешиваются с водой в любых соотношениях.
2. С увеличением числа гидроксильных групп повышаются относительная плотность и температура кипения спиртов: низкомолекулярные одноатомные – подвижные жидкости, 3х-атомный спирт глицерин – вязкая жидкость, 6-атомные спирты (манит) – твердые вещества. Спиртам присущи очень высокие по сравнению с алканами температуры кипения.
Это объясняется особенностями строения спиртов. Атом кислорода в молекуле спирта обладает большой электроотрицательностью и оттягивает на себя электронную плотность связанных с ним атомов, в частности атомов водорода. Связь О – Н в молекуле спирта сильно поляризована, поэтому между двумя молекулами возникает водородная связь. Молекулы, связанные водородными связями, образуют ассоциаты.
Для разрыва водородных связей при переходе молекулы из газообразного состояния требуется дополнительная энергия. Этим и объясняются высокие температуры кипения спиртов. Наибольшую склонность к образованию водородных связей проявляют первичные спирты.
3. спиртовой гидроксил сообщает молекуле сладкий вкус. Это свойство не проявляется у одноатомных спиртов (метиловый, этиловый), но уже 3х-атомный спирт глицерин имеет ясно выраженный сладкий вкус, а 6-атомный спирт манит близок к сахарам, а сами сахара – это многоатомные альдегидо- или кетоспирты.
Химические свойства
(см лекции по функциональному анализу)
1. Спирты имеют нейтральную реакцию в растворах
2. Спирты проявляют слабые кислотные свойства. Одноатомные взаимодействуют с активными металлами (Na, Ca и др.) c образованием алкоголятов:
2C2H5OH + 2Na → 2C2H5ONa + H2↑
В присутствии следов влаги алкоголяты разлагаются до исходных спиртов. Они являются более слабыми кислотами, чем вода, поэтому не вступают в реакцию со щелочами.
Благодаря кислотным свойствам многоатомные спирты образуют комплексы с солями тяжелых металлов.
3. При взаимодействии с органическими кислотами спирты образуют сложные эфиры. Реакция протекает в присутствии концентрированной серной кислоты
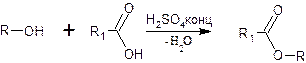
При взаимодействии с минеральными кислотами спирты образуют простые эфиры. 2 R – CH2 – OH → R – CH2 – O – CH2 – R
4. Спирты проявляют слабые восстановительные свойства. Окисление спиртов проводят сильными окислителями – смесью калия дихромата или калия перманганата с серной кислотой.
Первичные спирты окисляются до альдегидов, которые в свою очередь, могут окисляться до карбоновых кислот. Вторичные спирты окисляются до кетонов. Третичные спирты окисляются в жестких условиях с разрывом углеродной цепи.
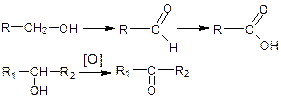
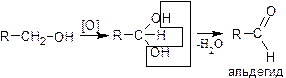
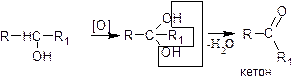
Имеются: ФС на спирт этиловый 95% и ФС на спирт этиловый 90%, 70%, 40%
C2H5OH Спирт этиловый Этанол
Spiritus aethylicus 95%(ЛН) Ethanol (МНН)
Spiritus aethylicus 90%, 70%, 40%
Получение
Спирт этиловый для медицинских целей получают из природного сырья, богатого сахаридами или полисахаридами (картофель, злаки, фрукты). Процесс сводится к гидролизу полисахаридов до мальтозы, а затем до глюкозы и получению спирта в результате брожения глюкозы:
2(С6Н10О5)n + nH2O → nC12H22O11 мальтоза
C12H22O11 + Н2О →  2С6Н10О6 глюкоза
2С6Н10О6 глюкоза
С6Н10О6 → 2С2Н5ОН + СО2↑
фермент дрожжей
C6H12O6 → 2 C2H5OH + 2CO2↑
зимаза
Спирт этиловый может быть получен и синтетическим путем:
А) из этилена:
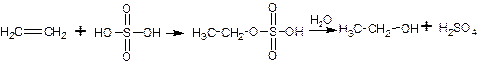
Б) из ацетилена по реакции Кучерова:
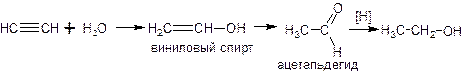
Описание
Спирт этиловый 95% – прозрачная, бесцветная, подвижная, летучая жидкость с характерным спиртовым запахом и жгучим вкусом. Кипит при температуре 78о, легко воспламеняется, горит синеватым слабо светящимся бездымным пламенем.
Спирт этиловый 90%, 70%, 40% – бесцветная, прозрачная жидкость с характерным спиртовым запахом.
Смешивается во всех соотношениях с водой, эфиром, хлороформом, ацетоном, глицерином.
Подлинность
Физические и физико-химические показатели и константы подлинности
| Структура и химическое название | латинское название | Объемная доля, % | Т кип, оС | Плотность, г/см3 |
| 1 | 2 | 3 | 4 | 5 |
| C2H5OH Спирт этиловый этанол | Spiritus aethylicus 95% | 95-96 | 78 | 0.812-0.808 |
| C2H5OH Спирт этиловый этанол | Spiritus aethylicus 90% 70% 40% | 90-91 70-71 39.5-40.5 | 0.830-0.826 0.886-0.883 0.949-0.947 |
1) Реакция этерификации с уксусной кислотой в присутствии концентрированной серной кислоты как водоотнимающего средства; образуется сложный эфир с запахом яблок.
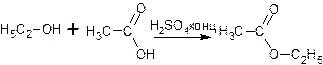
2) Реакция йодоформной пробы. При нагревании спирта этилового с йодом в щелочной среде ощущается характерный запах йодоформа и постепенно образуется желтый осадок йодоформа.
C2H5OH + 4I2 + 6NaOH → CHI3↓ + 5NaI + HCOONa + 5H2O
Следует помнить, что эта реакция не специфична, ее дает целый ряд соединений, содержащих в своей структуре группы –ОС2Н5, некоторые кетоны, альдегиды и оксикислоты.
3) При действии сильных окислителей спирт этиловый окисляется до ацеталдегида имеющего запах свежих яблок (дихроматом калия в среде H2SO4 конц.) и далее до кислоты уксусной.
3 C2H5OH + K2Cr2O7 + 4H2SO4 → 3 CH3COH + Cr2(SO4)3 + K2SO4 + 7H2O
Чистота
В процессе производства и хранения этиловый спирт может подвергаться загрязнению различными примесями:
1. недостаточная очистка от исходных, полупродуктов и побочных продуктов получения (непредельные соединения, сивушные масла, фурфурол)
2. возможные продукты окисления (ацетальдегид, уксусная кислота)
Контролируют чистоту только Спирта этилового 95%, т.к. спирт других концентраций готовят его разведением.
1) предел кислотности или щелочности (к раствору 20:25 добавляют 0,1мл фенолфталеина, жидкость должна быть бесцветной и окрашиваться в розовый цвет от прибавления не более 0,2мл (4 капли) 0,05н раствора гидроксида натрия и сохраняться в течение 30 сек).
2) допустимые пределы общих примесей хлоридов, сульфатов, тяжелых металлов. ГФ ХI т.1.
3) не допустимые нерастворимые в воде примеси (смесь воды и спирта1:1 должна быть прозрачной).
 2020-09-24
2020-09-24 492
492







