В основе вычислений лежит следующий принцип: вещества реагируют друг с другом всегда в эквивалентных количествах. Так, в кислотно-основном титровании до точки эквивалентности всегда расходуется одинаковое число эквивалентов кислоты и основания. Следовательно, при одинаковой молярной концентрации эквивалентов с эк реагирующих веществ реакции идут между их равными объемами. Например, на титрование 10 мл 0,1 н раствора любой кислоты расходуется такой же объем 0,1 н раствора любой щелочи.
Расчет массы навески стандартного вещества для приготовления титранта. Массу навески m (В) стандартного вещества В, необходимую для получения раствора с заданной молярной концентрацией эквивалентов с эк (В), рассчитывают по формуле:
m (В) = с эк(В) × M эк(В)× V р,
где M эк(В) – молярная масса эквивалентов стандартного вещества В, г/моль; V р – объем раствора, л.
Пример. Приготовить 100 мл 0,1 н раствора карбоната натрия Na2CO3.
Дано: с эк(Na2CO3) = 0,1н; Vр = 100мл. Найти массу карбоната натрия.
Решение. 1). Вычисляют молярную массу эквивалентов карбоната натрия
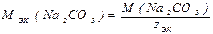 ,
,
z эк– эквивалентное число, равно 2.
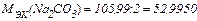 г/моль.
г/моль.
2). Находят массу навески:
m (Na2CO3) = 0,1×52,9950×0,1 = 0,52995 = 0,5300 г.
Вычисление результатов титриметрических определений. Результаты анализа в титриметрии вычисляют различными способами.
1. Вычисление результатов при выражении концентрации раствора через титр по определяемому веществу. Заводские и агрохимические лаборатории используют этот способ при массовых определениях одного и того же элемента в большом количестве проб.
Пример. Вычислить содержание гидроксида калия в анализируемом растворе, если на титрование было израсходовано 15 мл хлороводородной кислоты с титром 0,003647 г/мл.
Дано: V(HCl) = 15мл; Т (HCl) = 0,003647 г/мл. Найти массу гидроксида калия.
Решение.
1). Находим титр кислоты HCl по гидроксиду калия:
Т (HCl/КОН) = × М ЭК(КОН)/ М ЭК(HCl);
Т (HCl/КОН) = (0,003647 × 56,11):36,47 = 0,005611 г/мл.
2). Находим массу гидроксида калия в анализируемом растворе:
m (КОН) = 0,005611 × 15 = 0,08417 г.
2. Вычисление результатов при титровании по объемному методу (пипетирование). При этом используют уравнение (2): с эк(Х) · V (Х) = с эк(Т) · V (T).
Пример. В мерную колбу вместимостью 100 мл перенесли 0,6504 г, растворили и довели объем раствора водой до метки. Пипеткой брали по 10,00 мл полученного раствора и титровали 0,1026 н раствором гидроксида натрия, расход которого в среднем составил 9,85 мл. Определите массовую долю (%) H2C2O4 × 2H2O в технической щавелевой кислоте.
Дано: Vр = 100мл; m технич. щавелевой кислоты = 0,6504 г; V(H2C2O4 × 2H2O) = 10,00; V(NаОН) = 9,85мл; с эк(NаОН) = 0,1026н. Найти массовую долю (%) H2C2O4 × 2H2O в технической щавелевой кислоте.
Решение. 1). Вычисляют концентрацию раствора щавелевой кислоты по уравнению (2):
с эк(H2C2O4 × 2H2O) = 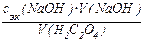 ;
;
с эк(H2C2O4 × 2H2O) = (0,1026 × 9,85):10,00 = 0,1011 моль/л.
2).Находят массу H2C2O4 × 2H2O в 0,1 л раствора. При этом исходят из того, что щавелевая кислота превращается в Na2C2O4, следовательно, молярная масса эквивалентов ее равна 1/2 молярной массы, т. е. М эк (H2C2O4 × ·2H2O) =126,06:2 = 63,03 г/моль. Поэтому:
m (H2C2O4 × 2H2O) = сЭК (H2C2O4 × 2H2O) × MЭК (H2C2O4 × 2H2O) × V р,
где V р – общий объем раствора щавелевой кислоты, л.
m (H2C2O4 × 2H2O) = 0,1011 × 63,03×0,1 = 0,6372 г.
3).Определяют массовую долю (%) H2C2O4 × 2H2O в технической щавелевой кислоте:
w(H2C2O4 × 2H2O) = 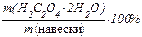 ;
;
w(H2C2O4 × 2H2O) = 0,6372:0,6504 = 0,9797, или 97,97%.
Лабораторная работа
 2020-09-24
2020-09-24 1588
1588








