Вариант №1
1. Какой объем 0,1050 н раствора гидроксида натрия расходуется на титрование 15 мл 0,0855 н раствора серной кислоты?
2. Какой объем раствора азотной кислоты (с плотностью 1,18г/см3) надо взять для приготовления 250 мл приблизительно 0,1 н раствора?
3. Что такое точка эквивалентности, как ее определяют?
Вариант №2
1. На титрование 25 мл 0,1210 н раствора гидроксида калия израсходовано 22,4 мл раствора хлороводородной кислоты. Вычислите молярную концентрацию эквивалентов и титр раствора НСI.
2. Какой объем раствора гидроксида натрия (с плотностью 1,285г/см3 ) надо взять для приготовления 200 мл 0,5 н раствора?
3. Что такое первичные стандартные растворы? Каковы требования, предъявляемые к первичным стандартным веществам?
Вариант №3
1. Какой объем 0,09820 н раствора серной кислоты расходуется на титрование 25 мл 0,1120 н раствора гидроксида калия?
2. Какой объем раствора соляной кислоты (с плотностью равной 1,068г/см3) необходим для приготовления 500 мл приблизительно 0,1 н раствора?
3. Как приготовить раствор тетрабората натрия? Напишите уравнения реакций и расчетные формулы.
Вариант №4
1. Какой объем раствора 0,1180 н раствора гидроксида натрия расходуется на титрование 20 мл 0,0990 н раствора щавелевой кислоты?
2. Рассчитайте молярную концентрацию, молярную концентрацию эквивалентов и титр раствора НNО3 с массовой долей 50%.
3. Почему, устанавливая титр раствора, пользуются той же мерной посудой, что и при выполнении самого определения? Перечислите виды мерной посуды.
Вариант №5
1. Какой объем 0,0995 н раствора азотной кислоты расходуется на титрование 15 мл 0,1280н раствора гидрокси да натрия?
2. Рассчитайте молярную концентрацию, молярную концентрацию эквивалентов и титр раствора гидроксида калия с массовой долей 44%.
3. Что такое титр раствора, титрование, титрант?
Вариант №6
1. Какой объем 0,1120н раствора соляной кислоты расходуется на титрование 25 мл 0,0820н раствора гидроксида натрия?
2. Рассчитайте молярную концентрацию, молярную концентрацию эквивалентов и титр раствора аммиака с массовой долей NН3 равной 18%.
3. Вторичный стандартный раствор, его стандартизация.
Вариант №7
1. На титрование 25 мл 0,1120н раствора гидроксида калия израсходовано 18,9 мл раствора серной кислоты. Рассчитайте молярную концентрацию эквивалентов и титр раствора Н2SО4.
2. Какой объем раствора азотной кислоты (с плотностью 1,22г/см3) надо взять для приготовления 250 мл приблизительно 0,15н раствор а?
3. Дайте определение понятиям: титрант, титрованный раствор.
Вариант №8
1. Какой объем 0,1160н раствора азотной кислоты расходуется на титрование 20 мл 0,0955н раствора гидроксида натрия?
2. Рассчитайте молярную концентрацию, молярную концентрацию эквивалентов и титр раствора гидроксида калия с массовой долей 54%.
3. Что такое конечная точка титрования, степень оттитрованности, кривая титрования?
Вариант №9
1.Навеску хлорида кальция массой 1,1100 г растворили в мерной колбе объемом 200 мл и довели объем до метки. Рассчитайте титр, молярную концентрацию и молярную концентрацию эквивалентов полученного раствора.
2. Какой объем раствора серной кислоты (с плотностью равной 1,415г/см3) необходим для приготовления 600мл приблизительно 0,2н раствора?
3. Что такое прямое титрование, обратное титрование?
Вариант №10
1. На титрование 30мл 0,1060н раствора уксусной кислоты затрачено 22,8 мл раствора гидроксида натрия. Рассчитайте молярную концентрацию эквивалентов и титр полученного раствора.
2. Какой объем раствора соляной кислоты (с плотностью равной 1,098г/см3) необходим для приготовления 400мл приблизительно 0,15н раствора?
3.Первичные стандартные растворы. Требования, предъявляемые к первичным стандартным веществам.
Вариант №11
1. Какой объем раствора азотной кислоты расходуется на титрование 15мл 0,1280н раствора гидроксида натрия?
2. Навеску нитрата кальция массой 0,8200г растворили в мерной колбе объемом 50мл и довели объем раствора водой до метки. Рассчитайте титр, молярную концентрацию и молярную концентрацию эквивалентов полученного раствора.
3. Что такое титрование, титр раствора, титрант?
Вариант №12
1. Какой смысл заключен в выражениях: 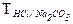 и
и 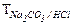 ? Вычислить титр HCl по карбонату натрия, если титр самой кислоты равен 0,003647 г/мл.
? Вычислить титр HCl по карбонату натрия, если титр самой кислоты равен 0,003647 г/мл.
2. Рассчитайте молярную концентрацию, молярную концентрацию эквивалентов и титр раствора азотной кислоты с массовой долей НNО3 равной 74%.
3. Что такое фиксанал? Как готовится вторичный стандартный раствор?
Вариант №13
1. Какой объем 0,1500 н раствора NaOH пойдет на титрование: а) 21,00 мл 0,1133 н раствора HCl; б) 21,00 мл раствора HCl с титром 0,003810?
2. Рассчитайте титр и молярную концентрацию эквивалентов раствора щавелевой кислоты, полученной растворением 94,5г ее в мерной колбе 1000мл.
3. Степень оттитрованности. Где используется значение степени оттитрованности?
Вариант №14
1. На титрование 10мл 0,1540н раствора гидроксида натрия затрачено 13,2мл раствора соляной кислоты. Рассчитайте молярную концентрацию эквивалентов и титр раствора соляной кислоты.
2. Какой объем раствора гидроксида калия (с плотностью равной 1,10г/см3) необходим для приготовления 150мл приблизительно 0,2н раствора?
3. Что такое точка эквивалентности? Какие существуют способы определения точки эквивалентности?
Вариант №15
1. Чему равны молярные массы эквивалентов H2SO4, H2SO3, Mg(OH)2 и Ba(OH)2 в реакциях полной нейтрализации и в реакциях неполной нейтрализации?
2. На титрование 20,00 мл раствора HNO3 затрачено 15,00 мл 0,1200 н раствора NaOH. Вычислите концентрацию, титр и массу HNO3 в 250 мл раствора.
3. Требования к реакциям в титриметрическом анализе.
 2020-09-24
2020-09-24 798
798








