При необратимом ингибировании происходит связывание или разрушение функциональных групп фермента, необходимых для проявления его активности.
Например, вещество диизопропилфторфосфат прочно и необратимо связывается с гидроксигруппой серина в активном центре фермента ацетилхолинэстеразы, гидролизующей ацетилхолин в нервных синапсах. Ингибирование этого фермента предотвращает распад ацетилхолина в синаптической щели, в результате чего медиатор продолжает оказывать воздействие на свои рецепторы, что бесконтрольно усиливает холинергическую регуляцию.
Аналогично диизопропилфторфосфат ингибирует химотрипсин и другие протеазы, имеющие в активном центре серин (сериновые протеазы).
Обратимое ингибирование
При обратимом ингибировании происходит непрочное связывание ингибитора с функциональными группами фермента, вследствие чего активность фермента постепенно восстанавливается.
Примером обратимого ингибитора может служить прозерин, связывающийся с ферментом ацетилхолинэстеразой в ее активном центре. Группа ингибиторов холинэстеразы (прозерин, дистигмин, галантамин) используется при миастении, после энцефалита, менингита, травм ЦНС.
Конкурентное ингибирование
При таком виде ингибирования ингибитор по своей структуре похож на субстрат фермента. Поэтому он соперничает с субстратом за активный центр (за контактный участок), что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата. При данном ингибировании максимальная скорость реакции остается вполне достижимой при создании высоких концентраций субстрата.
Например:
1. Ингибирование фермента цикла трикарбоновых кислотсукцинат-дегидрогеназы малоновой кислотой, структура которой схожа со структурой субстрата этого фермента – янтарной кислоты (сукцината).
В качестве других примеров лекарственных конкурентных ингибиторов можно привести
·ингибитор синтеза холестерина ловастатин, обратимо ингибирующий ГМГ-S-КоА-редуктазу,
·противоопухолевый препарат метотрексат, необратимо подавляющий дигидрофолатредуктазу,
·непрямой антикоагулянт дикумарол, конкурент витамина К,
·антигипертензивный препарат метил-ДОФА, подавляющий активность ДОФА-декарбоксилазы,
·средство для лечения подагры аллопуринол, ингибирующий ксантиноксидазу.
Примером конкуренции, но не ингибирования (!), является взаимодействие этанола и метанола за активный центр алкогольдегидрогеназы. В данном случае ингибирование, как таковое, отсутствует, но с активным центром фермента связывается тот спирт, концентрация которого больше. Данный эффект используют у пациентов с отравлением метанолом для которого этиловый спирт является антидотом.
Неконкурентное ингибирование
Данный вид ингибирования связан с присоединением ингибитора не в активном центре, а в другом месте молекулы. Но при этом меняется структура активного центра и связь с субстратом становится невозможной. Это может быть аллостерическое ингибирование, когда активность фермента снижается естественными модуляторами, или связывание с ферментом каких-либо веществ вне активного и аллостерического центра. Например:
·синильная кислота (цианиды) связывается с гемовым железом ферментов дыхательной цепи и блокирует клеточное дыхание,
·связывание ионов тяжелых металлов (Cu2+, Hg2+, Ag+) с SH-группами белков.
Особенностью неконкурентного ингибитора является его способность связываться с ферментом независимо от субстрата, т.е. изменение концентрации субстрата никак не влияет на образование комплекса фермент-ингибитор.
Бесконкурентное ингибирование
В этом случае ингибитор связывается в активном центре с фермент-субстратным комплексом. Повышение концентрации субстрата, увеличивая количество фермент-субстратного комплекса, усиливает и связывание ингибитора с ним. Таким образом, бесконкурентное ингибирование более сложно, чем другие типы ингибирования.
В качестве примера бесконкурентного ингибирования обычно называют связывание пенициллина и фермента транспептидазы, обеспечивающей сшивку цепей пептидогликана при синтезе клеточной стенки бактерий.
Смешанное ингибирование
При таком ингибировании ингибитор способен присоединяться везде – не только в активном центре, но и в других частях молекулы. Но после этого фермент еще способен частично сохранять свою активность. Примером является влияние мертиолата (ртутьорганическое вещество) на сахаразу грибов микромицетов для подавления их роста.
Аллопуринол – ингибитор ксантиноксидазы, фермента катаболизма пуринов, требуется для снижения образования мочевой кислоты и подавления развития гиперурикемии и подагры.
Ингибиторы гидроксиметилглутарил-SКоА-редуктазы (ловастатин, флувастатин, аторвастатин) применяются для снижения синтеза холестерола при атеросклерозе, заболеваниях сердечно-сосудистой системы, дислипопротеинемиях.
Ингибитор карбоангидразы (ацетазоламид) используется как мочегонное средство при лечении глаукомы, отеков, эпилепсии, алкалозах и горной болезни
Регуляция действия ферментов: аллостерические механизмы, химическая модификация. Белок-белковые взаимодействия. Примеры метаболических путей, регулирующих этими механизмами. Физиологическое значение регуляции действия ферментов.
- У группы регуляторных ферментов помимо активного центра, в молекуле фермента может присутствовать также аллостерический центр или центры (от греч. allos – другой и steros – пространственный, структурный), которые находятся за пределами активного центра. К аллостерическому центру могут присоединяться молекулы модуляторов (активаторов или ингибиторов), регулирующие активность ферментов. Присоединение модулятора к аллостерическому центру изменяет конформацию молекулы фермента и, соответственно, конфигурацию активного центра, вызывая повышение или снижение активности фермента.
Аллостерические ферменты обычно стоят в начале метаболических путей, и от их активности зависит течение многих последующих реакций. Поэтому они часто называются ключевыми ферментами. В качестве отрицательного регулятора может выступать конечный метаболит биохимического процесса или продукт данной реакции, т.е включается механизм обратной отрицательной связи. Если регуляторами являются начальный метаболит или субстрат реакции, то говорят о прямой регуляции, она может быть как положительной, так и отрицательной. Также регулятором могут быть метаболиты биохимических путей, каким-то образом связанных с данной реакцией. Например, фермент энергетического распада глюкозы, фосфофруктокиназа, регулируется промежуточными и конечными продуктами этого распада. При этом АТФ, лимонная кислота, фруктозо-1,6-дифосфат являются ингибиторами, а фруктозо-6-фосфат и АМФ – активаторами фермента. Аллостерическая регуляция имеет большое значение в следующих ситуациях:
-при анаболических процессах. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяют осуществлять регуляцию синтеза этих соединений;
-при катаболических процессах. В случае накопления АТФ в клетке происходит ингибирование метаболических путей, обеспечивающих синтез энергии. Субстраты при этом расходуются на реакции запасания резервных питательных веществ;
-для координации анаболических и катаболических путей. АТФ и АДФ - аллостерические эффекторы, действующие как антагонисты;
-для координации параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых для синтеза нуклеиновых кислот). Таким образом, конечные продукты одного метаболического пути могут быть аллостерическими эффекторами другого метаболического пути.
- Ковалентная (химическая) модификация заключается в обратимом присоединении или отщеплении определенной группы, благодаря чему изменяется активность фермента. Чаще всего такой группой является фосфорная кислота, реже метильные и ацетильные группы. Фосфорилирование фермента происходит по остаткам серина и тирозина. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление – протеинфосфатазы. Ферменты могут быть активны как в фосфорилированном, так и в дефосфорилированном состоянии. Например, ферменты гликогенфосфорилаза и гликогенсинтаза при потребности организма в глюкозе фосфорилируются, при этом фосфорилаза гликогена становится активной и начинает расщепление гликогена, а гликогенсинтаза неактивна. При необходимости синтеза гликогена оба фермента дефосфорилируются, синтаза при этом становится активной, фосфорилаза – неактивной.
- Белок-белковое взаимодействие обозначает ситуацию, когда в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки. В целом ситуация схожа с аллостерическим механизмом: после влияния каких-либо факторов на специфичные белки изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент. К примеру, мембранный фермент аденилатциклаза является чувствительным к воздействию мембранного G-белка, который сам активируется при действии на клетку некоторых гормонов (например, адреналина и глюкагона).
- Активность ферментов в клетке непостоянна во времени. Ферменты чутко реагируют на ситуацию, в которой оказывается клетка, на факторы, воздействующие на нее как снаружи, так и изнутри. Главная цель такой чувствительности ферментов – отреагировать на изменение окружающей среды, приспособить клетку к новым условиям, дать должный ответ на гормональные и иные стимулы, а в некоторых ситуациях – получить шанс выжить.
Роль ферментов в метаболизме. Многообразие ферментов. Понятие о классификации. Наследственные первичные энзимопатии: ФКУ, алкаптонурия. Другие примеры наследственных энзимопатий. Вторичные энзимопатии. Значение ферментов в медицине.
В клетке постоянно происходит большое количество разнообразных химических реакций, которые формируют метаболические пути - последовательное превращение одних соединений в другие. Метаболизм - совокупность всех метаболических путей, протекающих в клетках организма. Основу всех жизненных процессов составляют тысячи химических реакций, катализируемых ферментами.
1. Оксидоредуктазы — ускоряют реакции окисления — восстановления. Окисление протекает как процесс отнятия атомов Н (электронов) от субстрата, а восстановление — как присоединение атомов Н (электронов) к акцептору. Пример: каталаза.
2. Трансферазы — ускоряют реакции переноса функциональных групп и молекулярных остатков. В зависимости от характера переносимых группировок различают фосфотрансферазы, аминотрансферазы, гликозилтрансферазы, ацилтрансферазы, трансферазы, переносящие одноуглеродные остатки (метилтрансферазы, формил-трансферазы), и др. Например, амидазы ускоряют гидролиз амидов кислот. Из них важную роль в биохимических процессах в организме играют уреаза, аспарагиназа и глутаминаза. Уреаза ускоряет гидролиз мочевины до NН3 и СO2.
3. Гидролазы — ускоряют реакции гидролитического распада. Пример: эстеразы, пепсин, трипсин, амилаза.
4. Лиазы — ускоряют негидролитическое отщепление от субстратов определенных групп атомов с образованием двойной связи (или присоединяют группы атомов по двойной связи).
5. Изомеразы — ускоряют пространственные или структурные перестройки в пределах одной молекулы.
6. Лигазы — ускоряют реакции синтеза, сопряженные с распадом богатых энергией связей. Пример: ДНК-полимераза
В основе многих заболеваний лежат нарушения функционирования ферментов в клетке - энзимопатии. Различают первичные (наследственные) и вторичные (приобретённые) энзимопатии. При первичных энзимопатиях дефектные ферменты наследуются, в основном, по аутосомнорецессивному типу. Гетерозиготы, чаще всего, не имеют фенотипических отклонений. Первичные энзимопатии обычно относят к метаболическим болезням, так как происходит нарушение определённых метаболических путей.
Фенилкетонурия (ФКУ). Фенилаланин (ФА) принадлежит к числу незаменимых аминокислот. Только часть ФА используется для синтеза белков; основное количество этой аминокислоты окисляется до тирозина. Реакцию гидроксилирования ФА катализирует фермент – фенилаланингидроксилаза. Причина ФКУ – недостаточность этого фермента. В результате этого нарушения ФА не превращается в тирозин, из которого образуется фенилпировиноградной кислоты (ФПВК), которая выделяется с мочой и потом, вследствие чего от больных детей исходит "мышиный" запах. Высокая концентрация ФПВК приводит к нарушению формирования миелиновой оболочки вокруг аксонов в ЦНС. ФПВК является нейротропным ядом, в результате чего повышаются возбудимость, тонус мышц, развиваются гиперрефлексия, тремор, судорожные эпилептиформные припадки. Позже присоединяются нарушения высшей нервной деятельности, умственная отсталость, микроцефалия. У больных детей наблюдается слабая пигментация из-за нарушения синтеза меланина. Диагностика заболевания осуществляется биохимическими методами: ещё до развития клинической картины в моче определяется ФПВК, в крови - высокое содержание фенилаланина. В родильных домах обязательно проводится скрининг-тест на фенилкетонурию.
Алкаптонурия. Нарушено окисление гомогентизиновой кислоты в тканях (гомогентизиновая кислота - промежуточный метаболит катаболизма тирозина). У таких больных наблюдают недостаточность фермента окисления гомогентизиновой кислоты - диоксигеназы гомогентизиновой кислоты, приводящей к развитию заболевания. В результате увеличиваются концентрация гомогентизиновой кислоты и выведение её с мочой. В присутствии кислорода гомогентизиновая кислота превращается в соединение чёрного цвета - алкаптон. Поэтому моча таких больных на воздухе окрашивается в чёрный цвет. Алкаптон также образуется и в биологических жидкостях, оседая в тканях, коже, сухожилиях, суставах. При значительных отложениях алкаптона в суставах нарушается их подвижность.
Альбинизм. При альбинизме нарушен синтез в меланоцитах пигментов - меланинов. Меланин находится в коже, волосах, радужке, пигментном эпителии сетчатки глаза и влияет на их окраску. При альбинизме наблюдают слабую пигментацию кожи, светлые волосы, красноватый цвет радужки глаза из-за просвечивающих капилляров. Проявление альбинизма связано с недостаточностью фермента тирозингидроксилазы (тирозиназы) - одного из ферментов, катализирующего метаболический путь образования меланинов.
Вторичные (приобретенные) энзимопатии возникают как следствие заболеваний органов, вирусных инфекций и т.п., что приводит к нарушению синтеза фермента или условий его работы, например, гипераммониемия при заболеваниях печени, при которых ухудшается синтез мочевины и в крови накапливается аммиак. Другим примером может служить недостаточность ферментов желудочно-кишечного тракта при заболеваниях желудка, поджелудочной железы или желчного пузыря.
Недостаток витаминов и их коферментных форм также является причиной приобретенных ферментопатий.
- 1. Широкое применение в медицинской практике ферменты находят в качестве диагностических (энзимодиагностика)и терапевтических (энзимотерапия)средств. Ферменты также используются в качестве специфических реактивовдля определения ряда метаболитов. Например, фермент глюкозооксидазу применяют для количественного определения глюкозы в моче и крови; фермент уреазу используют для оценки содержания в биологических жидкостях мочевины; с помощью различных дегидрогеназ выявляют наличие соответствующих субстратов, например пирувата, лактата, этилового спирта и т.д.
2. Энзимодиагностиказаключается в постановке диагноза заболевания (или синдрома) на основе определения активности ферментов в биологических жидкостях человека.
3. Применение ферментов в качестве лекарственных препаратовактивно развивают в следующих направлениях:
• заместительная терапия - использование ферментов в случае их недостаточности;
• элементы комплексной терапии - применение ферментов в сочетании с другой терапией.
Сейчас ферментативные препараты применяются в хирургии, терапии, акушерстве и гинекологии, урологии, стоматологии, отоларингологии и многих других областях медицины.
Понятие о катаболизме и анаболизм и их взаимосвязи. Эндоргонические и экзергические реакции в метаболизме. Способы передачи электронов. Особенности протекания окислительных реакций в организме. Этапы расщепления веществ и освобождения энергии(этапы катаболизма).
- обмен веществ (метаболизм) – совокупность разнообразных биохимических процессов, в результате которых поступающие питательные вещества усваиваются, происходит освобождение энергии и синтез необходимых организму соединений. Метаболизм состоит из двух частей: анаболизма (синтеза сложных веществ из более простых с затратой энергии) и катаболизма (распада более сложных веществ до более простых с выделением энергии). Анаболизм и катаболизм неразрывно связаны между собой: анаболизм поставляет катаболизму вещество, катаболизм поставляет анаболизму энергию. Однако в условиях постоянной температуры передача энергии в виде тепла от одного химического процесса другому невозможна. Поэтому в живых системах имеет место передача энергии посредством особых макроэргических соединений, обладающих значительным запасом энергии. Универсальным макроэргическим соединением во всех клетках служит аденозинтрифосфорная кислота (аденозинтрифосфат, АТФ)
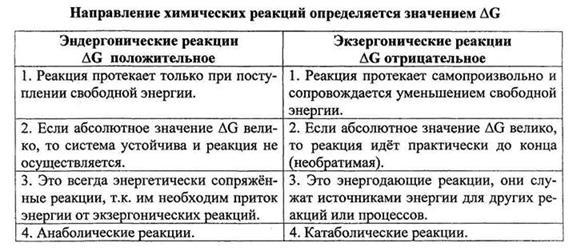 В живых системах в отношении направления химических реакций и биологических процессов действует принцип: эндергонические реакции текут за счет энергии освобождающейся в экзергонических реакциях.
В живых системах в отношении направления химических реакций и биологических процессов действует принцип: эндергонические реакции текут за счет энергии освобождающейся в экзергонических реакциях.
Анаболические (биосинтетические) процессы, требующие притока энергии, текут за счет энергии катаболических процессов (процессов распада молекул).
- В общем виде окислительно-восстановительную реакцию можно написать:
Донор электронов ↔ е- + Акцептор электронов
Способы передачи электронов от одной молекулы к другой:
I. Прямой перенос электронов.
Например, окислительно-восстановительная пара Fe2+ и Fe3+:
Fe2+ ↔ е- + Fe3+
II. Перенос электронов в составе атомов водорода(дегидрирование). Напомним, что атом водорода состоит из протона (Н+) и электрона (е-). В этом случае общее уравнение имеет вид:
ВН2 + А ↔ В+ АН2, где ВН2 – донор водорода (ВН2 ↔ В+ 2е- + 2Н+), А – акцептор водорода.
III. Перенос электронов путем прямого взаимодействия органического восстановителя с кислородом. В результате образуется продукт, в котором содержится ковалентно связанный кислород. Например, введение в состав органической молекулы атома кислорода с образованием гидроксильной группы:
R–CH3 + ½ О2 ↔ R–CH2–OH. В этой реакции донором электронов является органическая молекула, а атом кислорода играет роль акцептора.
Все окислительно-восстановительные реакции катализируются ферментами класса оксидоредуктаз. Все оксидоредуктазы относятся к сложным ферментам, т.е. содержат белковую часть – апофермент и небелковую часть – кофермент. Именно кофермент в составе оксидоредуктазы служит промежуточным переносчиком электронов/водорода от донора к акцептору в ходе окислительно-восстановительной реакции.
 Способы передачи электронов:1) прямой перенос электронов Fe²+ Cu²= Fe³+ Cu; 2) перенос электронов в составе гидрид иона (НАД и НАДФ), зависимые дегидрогеназы. 3) перенос электронов в составе атомов водорода (флавинзависимые дегидрогеназы); 4) перенос путем прямого взаимодействия ограничения восстановления СО2, приводящий к образованию продукта, в котором содержится ковалентно-связанный кислород. Самым главным с энергетической точки зрения является процесс отщепления водорода от субстрата с последующим его на кислород и воду.
Способы передачи электронов:1) прямой перенос электронов Fe²+ Cu²= Fe³+ Cu; 2) перенос электронов в составе гидрид иона (НАД и НАДФ), зависимые дегидрогеназы. 3) перенос электронов в составе атомов водорода (флавинзависимые дегидрогеназы); 4) перенос путем прямого взаимодействия ограничения восстановления СО2, приводящий к образованию продукта, в котором содержится ковалентно-связанный кислород. Самым главным с энергетической точки зрения является процесс отщепления водорода от субстрата с последующим его на кислород и воду.
-Этапы катаболизма:
1-й этап. На этом этапе макромолекулы расщепляются до своих мономеров (или строительных блоков). Так, полисахариды распадаются до моносахаридов; жиры - до глицерина и жирных кислот; белки - до аминокислот. Этот этап является специфическим, так как каждая макромолекула своим набором ферментов расщепляется до мономеров. 1-й этап катализируется ферментами класса гидролаз. Он локализован в пищеварительном тракте для пищевых макромолекул, а для эндогенных - лизосомах. Этот этап энергетической ценности не имеет. В нем выделяется менее 1% энергии, которая рассеивается в виде тепла.
2-й этап. Является специфическим путем катаболизма. На этом этапе каждый из мономеров своим собственным путем превращается в одну из карбоновых кислот. Моносахариды, глицерин и некоторые аминокислоты превращаются в пируват. Жирные кислоты и часть аминокислот - в ацетил-КоА. Некоторые аминокислоты превращаются в оксалоацетат или 2-оксоглутарат. 2-й этап происходит в митохондриях и цитозоле клеток. Образующаяся при этом энергия выделяется в виде тепла и используется на синтез АТФ.
3-этап. Является общим для разных классов веществ. На этом этапе пируват в процессе окислительного декарбоксилирования превращается в ацетил-КоА.Ацетил-КоА, оксалоацетат и 2-оксоглутарат окисляются в цикле Кребса. За один оборот цикла Кребса образуются 2 молекулы СО2,. Водород, полученный в дегидрогеназных реакциях, присоединяется к НАД+ и ФАД. с образованием НАДН и ФАДН2, которые окисляются в дыхательной цепи. При этом образуется вода, а выделившаяся энергия используется частично на синтез АТФ и частично рассеивается в виде тепла. Все реакции этого этапа локализованы в митохондриях.
Оксидоредуктазы. Классификация. Характеристика подклассов. НАД-зависимые дегидрогеназы. Строение окисленной и восстановленной форм. Важнейшие субстраты НАД-зависимых дегидрогеназ. ФАД-зависимые дегидрогеназы, сукцинатдегидрогеназа и ацилКоА-дегидрогеназа.
- 1. Оксидоредуктазы – ферменты, катализирующие окислительно-восстановительные реакции. Для ферментов этого класса характерны следующие особенности: – они формируют окислительно-восстановительные системы; – катализируют реакции, связанные с высвобождением энергии; – являются сложными ферментами, в качестве коферментов действуют НАД, ФАД, гем, KoQ. Научное (систематическое) название: название донора электронов: название акцептора электронов и название класса. Рабочее название: где возможно, используется термин дегидрогеназа или редуктаза. Если акцептором электронов является кислород – оксидаза
1. Дегидрогеназы - оксидоредуктазы, катализирующие дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода.
2. Если перенос водорода от молекулы донора трудно доказуем, то такие оксидоредуктазы называют редуктазами.
3. Оксидазы – оксидоредуктазы, катализирующие окисление субстратов с молекулярным кислородом в качестве акцептора электронов без включения кислорода в молекулу субстрата.
4. Монооксигеназы – оксидоредуктазы, катализирующие внедрение одного атома кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
5. Диоксигеназы – оксидоредуктазы, катализирующие внедрение 2 атомов кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
6. Пероксидазы – оксидоредуктазы, катализирующие реакции с пероксидом водорода в качестве акцептора электронов.
- НАД-зависимые дегидрогеназы
В реакциях, катализируемых этими ферментами, в качестве кофермента участвует НАД.
НАД-зависимые дегидрогеназы катализируют реакции окисления веществ путем дегидрирования; при этом окисляемое вещество служит донором водорода (DH2), а НАД выполняет роль акцептора водорода, т.е. восстанавливается. Остаток никотинамида в молекуле НАД принимает непосредственное участие в реакции.
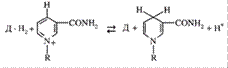

 2020-09-24
2020-09-24 639
639