В организме человека возможен синтез восьми заменимых аминокислот: Ала, Асп, Асн, Сер, Гли, Глу, Глн, Про. Углеродный скелет этих аминокислот образуется из глюкозы, α-аминогруппа вводится в соответствующие α- кетокислоты в результате реакций трансаминирования. Универсальным донором α-аминогруппы служит глутамат. Путём трансаминирования α-кетокислот, образующихся из глюкозы, синтезируются аминокислоты.

Глутамат также образуется при восстановительном аминировании α-кетоглутарата глутаматдегидрогеназой.
Эти реакции обратимы и играют большую роль как в процессе синтеза аминокислот, так и при их катаболизме. Такие реакции, выполняющие двойную функцию, называют амфиболическими.
Амиды глутамин и аспарагин синтезируются из соответствующих дикарбоновых аминокислот Глу и Асп. (схема А).
• Серин образуется из 3-фосфоглицерата — промежуточного продукта гликолиза, который окисляется до 3-фосфопирувата и затем трансаминируется с образованием серина (схема Б).

• Существует 2 пути синтеза глицина:
1) из серина с участием производного фолиевой кислоты в результате действия сериноксиметилтрансферазы:

2) в результате действия фермента глицин-синтазы в реакции:

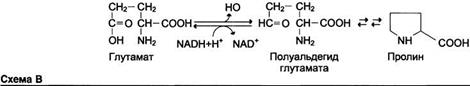
• Пролин синтезируется из глутамата в цепи обратимых реакций. Эти же реакции используются и при катаболизме пролина (см. схему).
Декарбоксилирование аминокислот. Его сущность. Декарбоксилирование гис,сер, цис, орн, лиз, глу. Роль биогенных аминов в регуляции метаболизма и функций.
 Декарбоксилирование аминокислот — это отщепление карбоксильной группы под действием фермента карбоксилаза, коферментом является пиридоксальфосфат. Образуются амины.
Декарбоксилирование аминокислот — это отщепление карбоксильной группы под действием фермента карбоксилаза, коферментом является пиридоксальфосфат. Образуются амины.
Гистидин — гистамин
Серин — Этаноламин — холин
Цистеин — меркаптоэтиламин
Орнитин — путресцин — спермин, спермидин
Лизин — кадаверин
Глутамат — ГАМК.
Трансаминирование аминокислот. Специфичность аминотрансфераз. Значение реакций трансаминирования. Непрямое дезаминирование аминокислот: последовательность реакций, ферменты, биологическое значение.
Трансаминирование аминокислот — это обратимый процесс обмена амино и кето групп под ферментом аминотрансфераза, является источником кетокислот и заменимых аминокислот.
Cуть этой реакции – обратимый перенос аминогруппы с аминокислоты на кетокислоту без промежуточного образования аммиака. Катализируют реакции трансаминирования ферменты трансаминазы (аминотрансферазы), в роли кофермента выступает пиридоксальфосфат (активная форма витамина В6).
В переаминировании участвует много аминокислот (кроме лизина, треонина), наиболее активными являются глутаминовая, аспарагиновая кислоты, что связывают с высоким содержанием в тканях животных двух специфических аминотрансфераз – аспартатаминотрансферазы и аланинаминотрансферазы. Аминотрансферазы участвуют в синтезе новых аминокислот из а-кетоглутарата. Этот синтез возможен и для получения незаменимых аминокислот, если с пищей будут поступать соответствующие кетокислоты.
Непрямое дезаминирование - Все аминокислоты, кроме глутаминовой, дезаминируются непрямым путем. Непрямое окислительное дезаминирование активно протекает во всех клетках организма и состоит из двух этапов:
1. Трансаминирования с а-кетоглутаратом с образованием глутамата (АМИНОТРАНСФЕРАЗА)
2. Прямого окислительного дезаминирования глутамата (ГЛУТАМАТ-ДГ). В результате трансаминирования а-кетоглутарат превращается в глутамат, а аминокислоты теряют аминогруппы и превращаются в а-кетокислоты. Далее их углеродный скелет катаболизируется специфическими путями и вовлекается в цикл Кребса, где сгорает до углекислого газа и воды. Глутаминовая кислота является коллектором всех аминогрупп, и только она подвергается прямому окислительному дезаминированию с образованием аммиака и а-кетоглутаровой кислоты.
 2020-09-24
2020-09-24 3079
3079
