а) аргентометрия основана на реакциях осаждения галогенидов (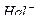 ) раствором нитрата серебра (титрант):
) раствором нитрата серебра (титрант):
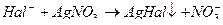
Аргентометрическое титрование в зависимости от химических свойств лекарственного вещества может быть выполнено прямым, обратным и косвенным методами.
Прямое титрование (метод Мора).
Титрантом является серебра нитрат 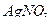 . Эквивалентную точку при прямом аргентометрическом определении устанавливают с помощью индикатора – калия хромата
. Эквивалентную точку при прямом аргентометрическом определении устанавливают с помощью индикатора – калия хромата 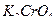 .
.
Реакции метода:
Присутствующий в анализируемом образце ион галогена взаимодействует с титрантом, образуя осадок белого цвета в случае хлоридов, желтоватый – в случае бромидов и желтый – иодидов:
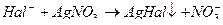
После осаждения всех ионов галогена, избыточная капля титранта взаимодействует с индикатором, образуя осадок красного цвета:
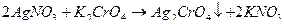
Обратное титрование (метод Фольгарда).
При обратном аргентометрическом титровании используется два рабочих раствора: серебра нитрат 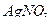 и тиоционат аммония
и тиоционат аммония 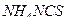 . Индикатором служат железоаммониевые квасцы.
. Индикатором служат железоаммониевые квасцы.
Реакции метода:
К анализируемому раствору добавляется избыток первого титрованного раствора:
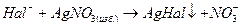
Далее избыток серебра нитрата оттитровывается вторым рабочим раствором:
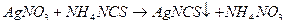
После того, как в растворе не останется серебра нитрата, избыточная капля аммония тиоционата взаимодействует с индикатором, образуя кроваво-красный раствор:
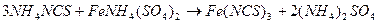
Этот же химический процесс лежит в основе количественного определения препаратов серебра. Он известен под названием тиоцианатометрии или роданометрии.
Косвенное титрование (метод Фаянса).
Титрантом является серебра нитрат и используются так называемые адсорбционные индикаторы, которые показывают изменение цвета не в растворах, а на поверхности выпавшего осадка.
Использование адсорбционных индикаторов основано на следующем. При титровании галогенидов образуется серебряная соль галогена, которая адсорбирует вначале на своей поверхности ионы галогена, находящиеся в избытке и заряжается отрицательно.
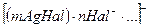
В конце титрования все галогены уже связаны, частицы теряют свой заряд и наблюдается процесс коагуляции. При добавлении даже незначительного избытка раствора 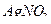 частицы адсорбируют ионы серебра, заряжаются положительно и притягивают к себе окрашенный анион адсорбированного индикатора. Осадок окрашивается, что и указывает на конец реакции.
частицы адсорбируют ионы серебра, заряжаются положительно и притягивают к себе окрашенный анион адсорбированного индикатора. Осадок окрашивается, что и указывает на конец реакции.
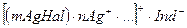
Прямым, обратным и косвенным аргентометрическим методом определяют неорганические лекарственные вещества, представляющие собой галогениды (хлориды, бромиды, иодиды) щелочных металлов, галогениды четвертичных аммониевых оснований (пентамин) и соли галогеноводородных кислот (гидрохлориды, гидробромиды, гидроиодиды) органических оснований, в том числе алкалоидов (морфина гидрохлорид, эфедрина гидрохлорид).
б) меркуриметия основана на образовании малодиссоциирующих соединений ртути (II). Например, при взаимодействии нитрата ртути с хлорид-ионами получается малодиссоциирующий дихлорид ртути:
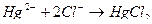
В эквивалентной точке избыток свободных ионов титранта (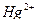 ) обнаруживают с помощью потенциометра или другими способами. При определении иодидов эквивалентную точку устанавливают по появлению красного осадка иодида ртути (II) вследствие разрушения образующегося в процессе титрования тетраиодомеркурат-иона:
) обнаруживают с помощью потенциометра или другими способами. При определении иодидов эквивалентную точку устанавливают по появлению красного осадка иодида ртути (II) вследствие разрушения образующегося в процессе титрования тетраиодомеркурат-иона:
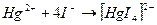
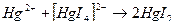
При титровании хлоридов в качестве индикаторов используют дифенилкарбазид или дифенилкарбазон:
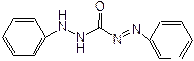
дифенилкарбазон
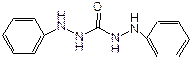
дифенилкарбазид
В эквивалентной точке они образуют сиреневого цвета комплексные соединения с ионом ртути (II), содержащимся в избытке титранта.
Существует вариант меркуриметрического титрования, основанный на использовании в качестве титранта раствора перхлората ртути и индикатора – дифенилкарбазона. Он позволяет количественно определять хлориды металлов и гидрохлориды органических оснований в присутствии различных неорганических соединений, органических спиртов, альдегидов, кислот алифатической, ароматической и гетероциклической структуры. Недостатком метода является отсутствие селективности в присутствии солей бромоводородной и иодоводородной кислот.
в) меркурометрия представляет собой метод определения анионов (главным образом галогенидов), образующих малорастворимые соединения с катионами ртути (I) 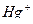 , содержащимися в титранте – растворе
, содержащимися в титранте – растворе 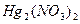 . Эквивалентную точку устанавливают по обесцвечиванию индикатора – тиоцианата железа (III)
. Эквивалентную точку устанавливают по обесцвечиванию индикатора – тиоцианата железа (III) 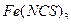 . Галогенид-ионы в процессе титрования полностью связываются в осадок
. Галогенид-ионы в процессе титрования полностью связываются в осадок 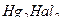 . При добавлении избыточной капли титранта ионы
. При добавлении избыточной капли титранта ионы 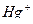 появляются в титруемом растворе. Они образуют с индикатором тиоцианатом железа (III) бесцветный тиоцианат ртути (I):
появляются в титруемом растворе. Они образуют с индикатором тиоцианатом железа (III) бесцветный тиоцианат ртути (I):
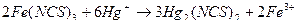
При определении галогенидов в меркурометрии в качестве индикаторов используют также бромфеноловый синий и дифенилкарбазон. Однако в отличие от кислотно-основного и меркуриметрического титрования они в данном случае выполняют роль адсорбционных индикаторов (подобно эозинату натрия в аргентометрии). Так, например, при титровании хлоридов образуется белый осадок 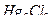 :
:
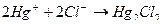
В эквивалентной точке избыточная капля титранта взаимодействует с индикатором, а он окрашивает поверхность осадка 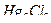 (или других галогенидов ртути) в синий цвет.
(или других галогенидов ртути) в синий цвет.
Нитритометрия.
Метод основан на реакциях первичных и вторичных ароматических аминов с нитритом натрия, который используют в качестве титранта.
Первичные ароматические амины образуют с нитритом натрия в кислой среде диазосоединение:
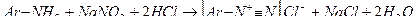
Вторичные ароматические амины в этих условиях образуют N-нитрозосоединения:
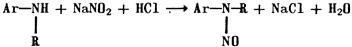
Эквивалентную точку устанавливают с помощью внешних индикаторов (иодкрахмальная бумага); внутренних индикаторов (тропеолин 00, нейтральный красный, смесь тропеолина 00 с метиленовым синим) или потенциометрически. При потенциометрическом титровании индикаторным служит платиновый электрод, а электродом сравнения хлор серебряный или насыщенный каломельный.
Нитритометрическое титрование проводят, как правило, при 15 – 20°С, в некоторых случаях анализируемый раствор охлаждают до 0 – 5° С. Кроме температуры на результаты нитритометрического титрования оказывают влияние концентрация хлористоводородной кислоты, природа растворителя и катализатора. В качестве последнего используют бромид калия. Он оказывает каталитическое действие на скорость титрования препаратов, повышает четкость перехода окраски внутренних индикаторов в точке эквивалентности и увеличивает скачок потенциала на платиновом электроде при потенциометрическом способе индикации.
При использовании внешнего индикатора – иодкрахмальной бумаги – титрование ведут до тех пор, пока капля титруемого раствора, взятая через 1 мин после прибавления титранта, не будет немедленно вызывать синее окрашивание на полоске иодкрахмальной бумаги.
Нитритометрию применяют в фармацевтическом анализе для определения сульфаниламидных препаратов (стрептоцид, норсульфазол, этазол, сульгин, сульфацил-натрий и др.), производных n-аминобензойной кислоты (анестезин, новокаин, новокаинамид), n-аминосалициловой кислоты (натрия n-аминосалицилат), представляющих собой первичные ароматические амины, а также вторичные амины (дикаин). Если первичная ароматическая аминогруппа ацилирована (парацетамол, стрептоцид растворимый), то обычно вещество предварительно гидролизуют. Ароматические нитропроизводные (левомицетин) вначале количественно восстанавливают до первичных аминов, а затем титруют нитритом натрия.
Вопросы для самоконтроля:
- Какая реакция лежит в основе метода нейтрализации?
- Какая реакция лежит в основе методов оксидиметрии?
- Какие методы нейтрализации вам известны?
- Назовите рабочие растворы, индикаторы, приведите химизм йодиметрии?
- Назовите рабочие растворы, индикаторы, приведите химизм перманганатометрии?
- Какие вещества определяют комплексонометрически?
- Чем обусловлен переход окраски в комплексонометрии?
 2020-09-24
2020-09-24 404
404








