В основе методов оксидиметрии лежит окислительно-восстановительная реакция. Названия методов обусловлены рабочим раствором.
а) перманганатометрия – рабочим раствором является калия перманганат 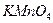 .
.
Определение проводят в кислой среде, так как есть возможность использовать 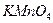 в качестве индикатора и окислительная способность перманганат-иона максимальна в кислой среде.
в качестве индикатора и окислительная способность перманганат-иона максимальна в кислой среде.
Пример взаимодействия:
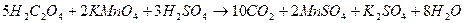
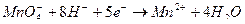
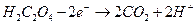
Фактор эквивалентности в перманганатометрии равен 1/z, где z – количество принятых или отданных электронов. Перманганат-ион принимает в результате реакции 5е-, т.о. f =1/5. Щавелевая кислота отдает 2е-, т.е. f =1/2.
Восстановители определяют прямым перманганатометрическим титрованием. Прямой метод используют для количественного определения железа восстановленного, препаратов пероксида водорода.
Окислители определяют обратной перманганатометрией. Избыток титранта устанавливается иодометрически.
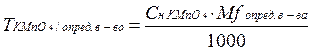 ,
,
Расчетная формула прямого титрования:
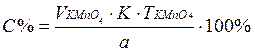 ,
,
С% – содержание анализируемого вещества, %;
V(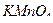 ) – объем калия перманганата, пошедшего на титрование, мл;
) – объем калия перманганата, пошедшего на титрование, мл;
К – поправочный коэффициент титрованного раствора 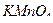 ;
;
Т(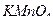 /опред. в-во) – титр
/опред. в-во) – титр 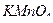 по определяемому веществу, г/мл;
по определяемому веществу, г/мл;
а – навеска анализируемого вещества, г.
б) йодометрия основана на использовании окислительных свойств свободного йода и восстановительных свойств иодид-ионов: 
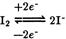
Рабочими растворами являются раствор 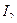 и
и 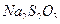 . Так как иод плохо растворяется в воде, его растворяют в растворе
. Так как иод плохо растворяется в воде, его растворяют в растворе 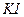 :
: 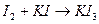
Методом прямой иодометрии количественно определяют неорганические и органические лекарственные вещества, способные окисляться или восстанавливаться, а также образовывать с йодом продукты замещения. Кроме того, иодометрию используют для определения избытка титранта в обратном иодатометрическом, броматометрическом, перманганатометрическом, иодхлорометрическом методах. Свободный йод, образовавшийся при окислении иодид-ионов или оставшийся в избытке при обратном иодометрическом титровании, оттитровывают тиосульфатом натрия:
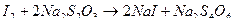
Индикатором обычно служит крахмал, образующий с иодом соединение, окрашенное в синий цвет.
Прямое титрование иодом применяют для определения натрия тиосульфата, препаратов мышьяка (III) и других веществ, проявляющих восстановительные свойства, например препаратов альдегидов (хлоралгидрат, формальдегид) в щелочной среде:
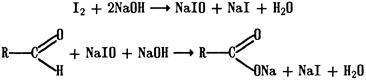
Определение окислителей проводят косвенным способом титрования. При этом в качестве вспомогательного компонента используют 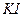 , который при взаимодействии с окислителем образует свободный иод.
, который при взаимодействии с окислителем образует свободный иод.
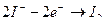
Выделившийся свободный иод оттитровывают тиосульфатом натрия. Этот процесс лежит в основе количественного определения препаратов перекиси (пероксида) водорода, соединений мышьяка (V), меди (II), калия перманганата, а также обладающих активными окислительными свойствами гипохлоритов (известь хлорная) и хлорпроизводных амидов сульфокислот (хлорамины, пантоцид).
Для количественного анализа используют также сочетание реакций замещения и иодометрии. С помощью титрованного раствора иода получают монозамещенные (антипирин), ди- и трииодпроизводные (фенолов, первичных ароматических аминов, в том числе сульфаниламидов, производных n-аминобензойной кислоты), тетраиодпроизводные (метиленовый синий). Полученные иодпроизводные, если они мешают титрованию, отфильтровывают, а в фильтрате определяют избыток титрованного раствора иода.
Ряд лекарственных веществ, представляющих собой органические основания, могут быть определены методом, который основан на их способности образовывать осадки полииодидов, имеющих состав 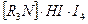 . Осадки отфильтровывают, а избыток иода оттитровывают тиосульфатом натрия.
. Осадки отфильтровывают, а избыток иода оттитровывают тиосульфатом натрия.
К их числу относятся ряд алкалоидов (хинина гидрохлорид, папаверина гидрохлорид, кодеин, кофеин, кокаина гидрохлорид, пахикарпина гидроиодид), витаминов (тиамина бромид), гетероциклические основания и их соли (хинозол, спазмолитин, дипрофен, дибазол, карбахолин, кватерон, амидопирин), четвертичные аммониевые соли (прозерин) и др.
в) йодатометрия используется для определения фтивазида, апрессина и кислоты аскорбиновой. Происходит процесс окисления лекарственных веществ титрованным раствором иодата калия. Избыток титранта устанавливают иодометрическим методом:
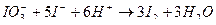
г) броматометрия.
В броматометрии в качестве титранта используют бромат калия, проявляющий в кислой среде окислительные свойства. Определение обычно ведут в присутствии бромида (бромид-броматометрия):
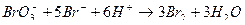
Выделяющийся свободный бром расходуется либо на окисление, либо на образование моно-, ди- или трибромпроизводных. Индикаторами служат красители, представляющие собой азосоединения (метиловый красный, метиловый оранжевый), которые окисляются и обесцвечиваются под действием избытка титранта после достижения эквивалентной точки. При использовании обратной броматометрии конец титрования устанавливают иодометрически, добавляя в титруемый раствор иодид калия:
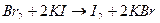
Объектами броматометрического титрования являются неорганические соединения мышьяка (III) и элементорганические соединения мышьяка (после предварительной минерализации). Обладая восстанавливающими свойствами, соединения мышьяка (III) окисляются броматом калия:
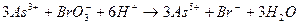
При количественном определении органических лекарственных веществ производных фенолов (фенол, тимол, резорцин, салициловая кислота) и первичных ароматических аминов (сульфаниламидные препараты, производные n-аминобензойной кислоты, натрия n-аминосалицилат) используют метод обратной броматометрии. Выделяющийся бром (в присутствии бромида) расходуется на галогенирование фенолов или аминов, образуя ди- или трибромпроизводные. Избыток брома определяют иодометрическим методом:
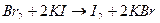
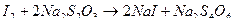
Лекарственные вещества, представляющие собой гидразины и гидразиды (изониазид, фтивазид, метазид, ниаламид), количественно определяют окислением, используя в качестве титрантов раствор иода, иодат калия, бромат калия, по общей схеме:
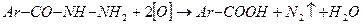
д) цериметрия – метод, основанный на использовании в качестве титранта солей церия (IV), которые в кислой среде восстанавливаются до церия (III):
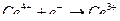
В качестве индикаторов используют дифениламин или о-фенантролин (фероин). При обратном титровании избыток титранта (сульфат церия) определяют иодометрически:
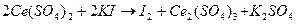
Ряд преимуществ отличают цериметрию от других окислительно-восстановительных методов анализа. Соединения церия (IV) обладают устойчивостью в титрованных растворах. Даже при температурах выше 100°С они не образуют промежуточных продуктов взаимодействия. Все это послужило предпосылкой для использования цериметрии в анализе как неорганических (соединений железа (II), мышьяка), так и органических (углеводов, органических кислот, производных фенотиазина) лекарственных веществ. Рекомендуют цериметрию для определения викасола, токоферола ацетата. Ее используют также для определения производных бензотиадиазина (дихлотиазид).
Существуют также и другие методы окислительно-восстановительного титрования.
Комплексонометрия.
Комплексонометрическое титрование основано на реакции комплексообразования катионов металлов с комплексонами – аминополикарбоновыми кислотами и их солями. Образующиеся комплексные соединения называют комплексонатами.
Наибольшее применение для комплексонометрического титрования получила динатриевая соль этилендиаминтетрауксусной кислоты (комплексон III, трилон Б,  ). Трилон Б образует с катионами различных металлов бесцветные, устойчивые и хорошо растворимые в воде комплексонаты.
). Трилон Б образует с катионами различных металлов бесцветные, устойчивые и хорошо растворимые в воде комплексонаты.
Взаимодействие происходит в стехиометрическом соотношении 1:1 независимо от заряда катиона:
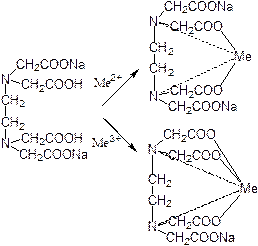
Именно поэтому фактор эквивалентности в комплексонометрии всегда равен 1.
Комплексонометрическое титрование применяют для количественного определения неорганических и элементорганических лекарственных препаратов, содержащих ионы магния, кальция, цинка, висмута, свинца, алюминия и др.
Индикаторы, применяемые в комплексонометрии, называются металлоиндикаторами. Они представляют собой органические красители и образуют с ионами металлов непрочные ярко окрашенные комплексы. В конце титрования эти комплексы разрушаются, меняя окраску в эквивалентной точке. Металлоиндикаторы для комплексонометрии подбираются так, чтобы их взаимодействие с катионами определяемых металлов было обратимым и устойчивость соответствующих комплексов была заметно меньше устойчивости комплексонатов, образующихся в процессе титрования.
Реакции метода:
При добавлении металлоиндикатора к исследуемому раствору, содержащему ионы металлов, происходит образование комплекса (показано на примере двухзарядного металла):
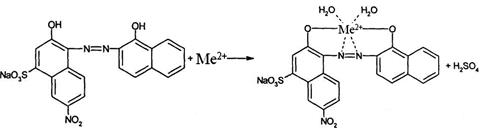 (1)
(1)
синий винно-красный
При последующем добавлении титранта (трилона Б), последний вытесняет индикатор из его комплекса с катионом металла:
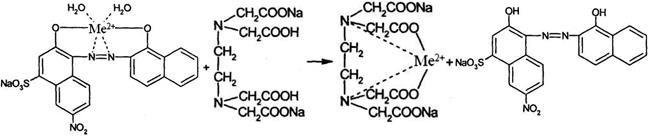
винно-красный синий
Изменение окраски является следствием перехода индикатора в свободное состояние.
В ГФ XII включены следующие металлоиндикаторы: ксиленоловый оранжевый, хальконкарбоновая кислота, хромовый темно-синий (кислотный хром темно-синий), эриохром черный Т (протравной черный II). Непременным условием комплексонометрического титрования является соблюдение определенного интервала значений рН, которое достигается с помощью буферных растворов. Титрование большинства катионов проводят обычно в среде аммиачного буфера, который поддерживает рН = 8 – 10. При рН меньше 8 равновесие уравнения (1) будет смещаться влево, т.о. не будет образовываться комплекс индикатора с металлом. При рН больше 10 будут выпадать в осадок гидроксиды определяемых металлов.
При прямом титровании к анализируемому раствору солей кальция, магния, цинка, висмута, свинца и других добавляют необходимый объем буферного раствора для достижения нужного значения рН и указанное в частной статье количество металлоиндикатора. Затем титруют 0,05 М раствором трилона Б до тех пор, пока в эквивалентной точке не произойдет изменение окраски индикатора.
При обратном титровании избыток трилона Б, не вступивший во взаимодействие с анализируемым катионом, оттитровывают, используя в качестве титрантов растворы солей цинка, магния, свинца и др. Титруют в присутствии металлоиндикатора при определенном значении рН среды.
Комплексонометрию используют для количественного определения неорганических фармакопейных препаратов магния (магния оксид, магния сульфат, магния карбонат основной); цинка (цинка оксид, цинка сульфат); свинца (свинца оксид); кальция (кальция хлорид); висмута (висмута нитрат основной). Кальциевые соли органических кислот, растворимые в воде (кальция лактат, кальция глюконат, кальция пангамат, кальция пантотенат), определяют так же, как и кальция хлорид. Нерастворимый в воде бепаск (n-бензоиламиносалицилат кальция) предварительно минерализиуют прокаливанием до образования оксида кальция, а затем растворяют в хлористоводородной кислоте и титруют раствором трилона Б.
Комплексонометрию применяют и для количественного анализа органических и элементорганических соединений, в том числе и лекарственных веществ. Анализ может быть выполнен методом как прямого, так и обратного титрования по катиону металла, входящего в молекулу препарата, или по аниону с использованием титрованного раствора, содержащего катион металла. Ряд методик основан на образовании комплексных соединений с ионами меди (II), цинка, свинца и др. (избыток которых титруют трилоном Б). Аналогичным образом выполняют определение после осаждения препарата в виде соли.
 2020-09-24
2020-09-24 317
317








