| Препарат | Химическая формула | Описание |
| Magnesii oxydum – магния окись, магния оксид | 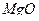
| Белый мелкий легкий порошок без запаха |
| Magnesii subcarbonas – магния карбонат основной | 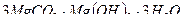
| Белый легкий порошок без запаха и вкуса |
| Magnesii sulfas – магния сульфат | 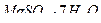
| Бесцветные призматические выветривающиеся кристаллы |
Магния оксид и магния сульфат различаются по физическим свойствам. Магния оксид (MgO) практически нерастворим в воде (свободной от примеси углекислого газа) и в этаноле, но растворим в разведённых кислотах.
Магния сульфат (MgSO4) легко растворим в воде, практически нерастворим в этаноле.
Перед испытаниями на подлинность магния оксид предварительно растворяют в разведенных кислотах.
Качественные реакции на ион магния:
1. Реакция с динатрия гидрофосфатом и раствором аммиака. Образуется нерастворимый в воде, но растворимый в уксусной кислоте белый кристаллический осадок фосфата магния-аммония. Осадок выпадает при добавлении к раствору соли магния. К реакционной смеси необходимо прибавлять раствор хлорида аммония (до рН 9) во избежание образования в щелочной среде аморфного осадка гидроксида магния Mg(OH)2.
2. Осаждение Mg2+ из растворов в хлористоводородной кислоте избытком гидроксида натрия. Образующийся гидроксид магния представляет собой белый студенистый осадок, нерастворимый в избытке раствора гидроксида натрия.
3. Реакция с хинализарином (1,2,5,8-тетраоксиантрахинон) в щелочной среде. Образуется малорастворимое соединение синегоцвета.
4. Реакция с 8-оксихинолином (при рН 9 – 12). В результате реакции образуется флуоресцирующий зелёным светом оксихинолинат магния.
5. Реактивами на ион магния являются дифенилкарбазид, титановый жёлтый, магнезоны I и II. Последние используют для количественного фотометрического определения магния.
В магния сульфате устанавливают наличие сульфат-иона: при взаимодействии с бария хлоридом выпадает белый осадок.
Соединения магния количественно определяют прямым комплексонометрическим методом титрования.
Соединения магния хранят в хорошо укупоренной таре, так как магния оксид взаимодействует с углекислым газом и влагой, содержащимися в воздухе, образуя примесь карбоната и гидроксида магния. Магния сульфат в плохо укупоренной таре постепенно теряет кристаллизационную воду.
Магния оксид применяют при повышенной кислотности желудочного сока. Магния сульфат проявляет слабительный эффект при приеме внутрь больших доз (10 – 30 г). При парентеральном введении 20 – 25%-ных растворов магния сульфат оказывает успокаивающее действие, поэтому его назначают в качестве седативного, противосудорожного, спазмолитического средства.
Соединения цинка.
 2020-09-24
2020-09-24 427
427








