| Препарат | Химическая формула | Описание |
| Acidum ascorbinicum – кислота аскорбиновая | 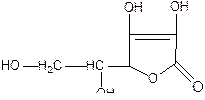
| Белый кристаллический порошок без запаха, кислого вкуса. Тпл. 190 – 193 оС (с разложением). Удельное вращение от +22° до +24° (2%-ный водный раствор) |
Кислота аскорбиновая, являющаяся γ-лактоном, легко растворима в воде, медленно растворима в этаноле и практически нерастворима в эфире, бензоле и хлороформе. Раствор кислоты аскорбиновой в буферном растворе (рН 7) имеет максимум поглощения при 265 нм. В кристаллической форме кислота аскорбиновая устойчива. В растворах под действием слабых окислителей различной природы она окисляется до дегидроаскорбиновой кислоты. Процесс этот – обратимый. Кислотные свойства кислоте аскорбиновой придает наличие в молекуле двух енольных гидроксилов. В разбавленных растворах щелочей она ведет себя как одноосновная кислота.
Качественные реакции на кислоту аскорбиновую, основанные на ее кислотных свойствах:
1. Реакция с железа (II) сульфатом (после добавления карбоната натрия); появляется темно-фиолетовое окрашивание, обусловленное образованием аскорбината железа, исчезающее после добавления разведенной серной кислоты.
Качественные реакции на кислоту аскорбиновую, основанные на ее восстановительных свойствах:
1. Реакция с реактивом Фелинга; появляется оранжево-желтый осадок оксида меди (I).
2. Реакция «серебряного зеркала» с раствором нитрата серебра; его катион восстанавливается до металлического серебра.
3. Реакция с раствором 2,6-дихлорфенолиндофенола, который имеет синий цвет; образуется бесцветное лейкооснование. Аналогичную реакцию кислота аскорбиновая дает с раствором метиленового синего.
4. Реакция окисления с раствором йода или перманганата калия; в результате происходит их обесцвечивание. Нитраты превращаются в нитриты, арсенаты в арсениты.
5. Реакция с фосфорномолибденовой кислотой; образуется окрашенный в синий цвет продукт реакции.
6. Реакция с раствором меди (II) сульфата и аммония тиоцианата; выпадает белый осадок меди (I) тиоцианата.
7. Реакция с раствором железа (III) хлорида; происходит обесцвечивание раствора. При последующем добавлении гексацианоферрата (III) калия образуется турнбулева синь.
- Цветная реакция с 0,5%-ным раствором хлорида трифенилтетразолия в присутствии раствора гидроксида натрия. Выпадает красный осадок трифенилформазана.
9. Реакция с нингидрином; появляется красновато-коричневое окрашивание.
10. Восстановление оксида селена (IV) до красного элементного селена.
11. Реакция обесцвечивания раствора хлоранила.
Количественно по ФС определяют кислоту аскорбиновую методами алкалиметрии, йодатометрии, йодометрии, иодхлорометрии, цериметрии, фотоколориметрии.
Кислоту аскорбиновую хранят в хорошо укупоренной таре, предохраняя от действия света и кислорода воздуха. Весьма устойчивая в кристаллической форме (в отсутствие влаги), она в растворах быстро окисляется.
Кислоту аскорбиновую (витамин С) применяют в профилактических и лечебных целях при цинге, кровотечениях различной этиологии, инфекционных заболеваниях и интоксикациях, заболеваниях печени, почек и т.д. Назначают внутрь по 0,05 – 0,1 г 3 – 5 раз в день. Внутримышечно и внутривенно вводят по 1 – 3 мл 5%-ного раствора натрия аскорбината.
 2020-09-24
2020-09-24 314
314








