Задание № 1 рассчитано на проверку знаний понятий «атом», «молекула», химический элемент, умений определять простые и сложные вещества.
Перед выполнением предложенных заданий повторите:
Атомы— мельчайшие химически неделимые частицы, из которых состоят вещества. Атомы различаются между собой строением (числом содержащихся в них частиц), а также массой и размерами. В химических реакциях атомы не изменяются, а только перегруппировываются — объединяются в новых комбинациях. Пример: атомы кислорода образуют два вещества. Когда они соединяются попарно, то образуется кислород. Если же три атома кислорода образуют молекулу, то образуется озон.
Молекула — мельчайшая частица вещества, сохраняющая его состав и химические свойства и состоящая из атомов. Молекулы характеризуются качественным и количественным составом.
Качественный состав показывает, из каких атомов состоит молекула. Пример: молекулы воды и пероксида водорода состоят из атомов водорода и кислорода, а молекула углекислого газа — из атомов углерода и кислорода.
Количественный состав показывает, сколько атомов каждого вида содержится в молекуле. Пример: молекула воды состоит из двух атомов водорода и одного атома кислорода, а молекула пероксида водорода — из двух атомов водорода и двух атомов кислорода.
В молекулах может быть разное число атомов. У инертных газов - молекулы одноатомные. Молекулы кислорода, водорода, азота, хлора, брома, йода двухатомные. Молекула этилового спирта содержит 2 атома углерода, 6 атомов водорода и 1 атом кислорода. В химических реакциях молекулы не сохраняются, а разрушаются до атомов.
Химический элемент — определённый вид атомов. Атомы разных химических элементов отличаются массой, размерами, строением и свойствами. Атомы химических элементов соединяются друг с другом в разных комбинациях и образуют огромное количество природных и синтетических веществ.
Простые вещества — вещества, молекулы которых состоят из атомов одного вида. Одноатомные молекулы образуют инертные газы гелий He, неон Ne, аргон Ar и другие. Из двухатомных молекул состоят водород H2, кислород O2, азот N2, галогены F2, Cl2, Br2, I2. Три атома — в молекулах озона O3, четыре — в молекулах белого фосфора P4, восемь — в молекулах серы S8.
Другая группа простых веществ имеет немолекулярное строение. К таким веществам относятся все металлы, а также фосфор красный, алмаз, графит, кремний и другие. Пример: химический элемент кислород образует простые вещества, отличающиеся составом молекул: кислород O2 и озон O3. Кислород — газ без запаха, необходим живым организмам для дыхания. Озон имеет запах, ядовит.
Сложные вещества — вещества, молекулы которых состоят из атомов разного вида. Большинство химических веществ являются сложными. При определённых условиях сложные вещества можно разложить на несколько новых веществ. Так под действием электрического тока вода разлагается на водород и кислород, а сахар при нагревании превращается в уголь и воду.
Обрати внимание! Свойства сложного вещества не являются суммой свойств веществ, образующихся при его разложении.
Задание
Выберите два высказывания, в которых говорится о кислороде как о химическом элементе.
1) Вода под действием электрического тока разлагается на кислород и водород.
2) Кислород реагирует с алюминием.
3) Углекислый газ содержит в своём составе кислород и углерод.
4) Природный газ горит в кислороде.
5) Кислород входит в состав оксидов.
Ответ: 35
Пояснение:
(1) Молекула воды разлагается на молекулы кислорода и водорода. (2) Кислород реагирует с алюминием в виде молекул веществ. (4) Природный газ горит в кислороде (молекуле). (3) Углекислый газ СО2 состоит из двух химических элементов – углерода и кислорода. (5) В составе любого оксида обязательным химическим элементом является кислород.
Тренировочные задания:
1. Выберите два высказывания, в которых говорится о фосфоре как о химическом элементе:
1) Молекула фосфина состоит из 3 атомов водорода и 1 атома фосфора;
2) Фосфор входит в состав смеси, наносимой на стенку спичечной коробки;
3) Фосфор имеет несколько аллотропных модификаций;
4) Фосфор входит в состав растительных и животных белков;
5) Чёрный фосфор обладает полупроводниковыми свойствами.
2. Выберите два высказывания, в которых говорится о сере как о химическом элементе:
1) Сера входит с состав некоторых аминокислот;
2) Сера — это порошок жёлтого цвета, который не смачивается водой;
3) Молекула сероводорода состоит из 2 атомов водорода и 1 атома серы;
4) Сера не притягивается магнитом;
5) Серу применяют для вулканизации каучука.
3. Выберите два высказывания, в которых говорится о водороде как о химическом элементе:
1) Водород входит в состав большинства органических соединений;
2) Водород — самый лёгкий газ;
3) Водородом заполняют воздушные шары;
4) Водород содержится в вулканических газах;
5) Молекула метана содержит 4 атома водорода.
4. Выберите два высказывания, в которых говорится о хлоре как о химическом элементе:
1) Хлор — жёлто-зелёный удушающий газ;
2) Атомная масса хлора составляет 35,453 а. е. м.;
3) Молекула соляной кислоты содержит 1 атом хлора;
4) Хлор использовался как боевое отравляющее вещество;
5) Хлор при попадании в лёгкие вызывает ожог лёгочной ткани.
5. Выберите два высказывания, в которых говорится о галлии как о химическом элементе:
1) Галлий — мягкий хрупкий металл серебристо-белого цвета;
2) Существование галлия было научно предсказано Д. И. Менделеевым;
3) Чистый галлий плавится на руке человека;
4) Галлием заполняют термометры для измерения высоких температур;
5) В состав полупроводниковых материалов часто входит галлий.
6. Выберите два высказывания, в которых говорится о селене как о химическом элементе:
1) Селен — хрупкий блестящий на изломе неметалл чёрного цвета;
2) Селен не способен гореть на воздухе самостоятельно;
3) Селен входит в состав активного центра ферментов метаболизма нуклеиновых кислот, липидов, гормонов;
4) Селен — аналог серы и проявляет степени окисления −2, +4 и +6;
5) Селен в чистом виде широко использовался в середине 20-го века в военной технике.
7. Выберите два высказывания, в которых говорится о натрии как о химическом элементе:
1) Натрий — мягкий щелочной металл серебристо-белого цвета;
2) Натрий — шестой по распространённости в земной коре;
3) Натрий под высоким давлением становится прозрачным и красным, как рубин;
4) Натрий содержится в морской воде;
5) Натрий широко используется в металлургии.
8. Выберите два высказывания, в которых говорится о неоне как о химическом элементе:
1) Неон принадлежит к VIIIА группе — инертным газам;
2) Неон химически инертен;
3) Неон — пятый по распространённости во Вселенной;
4) Неон используют в качестве охладителя в криогенных установках;
5) Французский изобретатель Жорж Клод создал газоразрядную лампу, заполненную неоном.
9. Выберите два высказывания, в которых говорится об алюминии как о химическом элементе:
1) Алюминий — лёгкий металл серебристо-белого цвета;
2) Термитная смесь, в состав которой входит алюминий, используется в качестве зажигательных составов;
3) Алюминий легко реагирует с простыми веществами;
4) Алюминий восстанавливает металлы из их оксидов (алюминотермия);
5) На данный момент не известно ни одно живое существо, использующее алюминий в метаболизме, — это «мёртвый» металл.
10. Выберите два высказывания, в которых говорится о йоде как о химическом элементе:
1) Йод входит в скелетный белок губок;
2) Йод — кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары;
3) 5 %-ный спиртовой раствор йода используется для дезинфекции кожи вокруг раны;
4) Йод используется в источниках света;
5) Отсутствие или недостаток йода в рационе приводит к заболеваниям.
Ответы
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 14 | 13 | 15 | 23 | 25 | 34 | 24 | 13 | 25 | 15 |
Задание 2. Строение атома. Строение электронных оболочек атомов первых 20 химических элементов Периодической системы Д. И. Менделеева.
Задание № 2 рассчитано на проверку знаний строения атома, строения электронных оболочек атома первых 20 элементов Периодической системы Д. И. Менделеева.
Перед выполнением предложенных заданий повторите:
· Число электронов на внешнем уровне определяется номером группы.
· Число энергетических уровней показывает номер периода, в котором находится элемент.
· Порядковый номер элемента показывает заряд ядра и общее число электронов в атоме.
· Число нейтронов определяется, как разница между атомной массой элемента и его порядковым номером.
· Элементы, находящиеся в одной группе имеют разное число энергетических уровней, разный заряд ядра и разное число нейтронов и протонов в атоме и одинаковое число электронов на внешнем энергетическом уровне.
Обрати внимание! Порядковый номер элемента = заряд ядра атома = число протонов в ядре = число электронов в атоме. Пример. Водород — элемент № 1. Заряд ядра его атома равен +1. В ядре находится один протон, а в электронной оболочке — один электрон. Пример. Углерод — элемент № 6. Заряд ядра его атома равен +6, в нём — 6 протонов. В атоме содержится 6 электронов с общим зарядом –6.
Задание
1. На приведённом рисунке изображена модель атома:
1) бора; 2) алюминия; 3) азота; 4) бериллия.
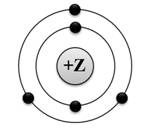
Ответ: 1
Пояснение: на изображенной модели атома видно, что это атом 2 периода, имеющий во внешнем электронном слое атома 3 электрона. Следовательно, это элемент 2 периода III группы – бор.
2. Три электрона находятся во внешнем электронном слое атома каждого из двух химических элементов:
1) Al и B; 2) Mg и S; 3) Al и Ca; 4) N и P.
Ответ: 1
Пояснение: Три электрона во внешнем электронном слое атома имеют элементы III А группы – то есть Al и В.
3. Распределение электронов по электронным слоям: 2; 8; 8; 1 — соответствует атому, расположенному
1) в 4 периоде, IVА группе;
2) в 3 периоде, IVА группе;
3) в 4 периоде, I А группе;
4) в 3 периоде, I А группе.
Ответ: 3
Пояснение: Число электронов в атоме равно порядковому номеру. Сумма электронов – 19. Химический элемент – калий – находится в 4 периоде I А группы.
Тренировочные задания:
1. Одинаковое число электронных слоев, содержащих электроны, имеют атомы элементов:
1) Al и S 2) N и Si 3) Li и Na 4) He и Ne
2. Пять электронов находятся во внешнем электронном слое атома
1) бора 2) стронция 3) фосфора 4) неона
3. На приведённом рисунке изображена модель атома химического элемента
1) 2-го периода VA группы
2) 3-го периода VIIA группы
3) 3-го периода VA группы
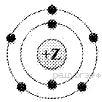 4) 2-го периода VIIA группы
4) 2-го периода VIIA группы
4. Сколько электронов находится во внешнем электронном слое атома, в ядре которого 14 протонов?
1) 2 2) 4 3) 8 4) 14
5. Схема строения электронных оболочек соответствует атому химического элемента
1) 2-го периода VIIA группы 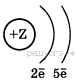 2) 5-го периода VIIA группы
2) 5-го периода VIIA группы
3) 2-го периода VA группы 4) 5-го периода IIА группы
6. Распределению электронов в атоме химического элемента соответствует ряд чисел: 2, 8, 3. В Периодической системе Д. И. Менделеева этот элемент расположен
1) в 3-м периоде, IIIА группе 2) в 3-м периоде, IIA группе
3) во 2-м периоде, IIA группе 4) во 2-м периоде, IIIA группе
7. Заряд ядра атома химического элемента, расположенного во 2-м периоде, IVA группе равен: 1) +4 2) +12 3) +8 4) +6
8. Четыре электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
1) C, Si, Sn 2) O, Cl, I 3) N, C, S 4) Mg, Be, Ca
9. Химический элемент, в атомах которого распределение электронов по слоям: 2, 8, 6, образует высший оксид
1) SeO3 2) SO3 3) N2O3 4) P2O3
10. Химический элемент, в атомах которого распределение электронов по слоям: 2, 8, 4, образует водородное соединение:
1) CH4 2) NH3 3) SiH4 4) H2S
Ответы:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 1 | 3 | 1 | 2 | 3 | 1 | 4 | 1 | 2 | 3 |
Задание 3. Закономерности изменения свойств элементов в связи с положением в Периодической системе химических элементов
Задание № 3 рассчитано на проверку понимания смысла Периодического закона и умения использовать его для качественного анализа и обоснования основных закономерностей строения атома.
Перед выполнением предложенных заданий повторите:
| химического элемента и их свойства | Изменения свойств | ||
| В главных (А) подгруппах (сверху вниз) | В периодах (слева направо) | ||
| Атомы | Заряд ядра | Увеличивается | Увеличивается |
| Число энергетических уровней | Увеличивается | Не изменяется = номер периода | |
| Число электронов на внешнем уровне | Не изменяется = номеру периода | Увеличивается | |
| Радиус атома | Увеличиваются | Уменьшается | |
| Восстановительные свойства | Увеличиваются | Уменьшаются | |
| Окислительные свойства | Уменьшаются | Увеличиваются | |
| Высшая положительная степень окисления | Постоянная = номеру группы | Увеличивается от +1 до +7 (+8) | |
| Низшая степень окисления | Не изменяется = (8 - № группы) | Увеличивается от -4 до -1 | |
| Простые вещества | Металлические свойства | Увеличивается | Уменьшаются |
| Неметаллические свойства | Уменьшаются | Увеличивается | |
| Соединения элементов | Характер химических свойств высшего оксида и высшего гидроксида | Усиление основных свойств и ослабление кислотных свойств | Усиление кис-лотных свойств и ослабление основных свойств |
 2020-09-24
2020-09-24 1135
1135
