1. Дана схема превращений: 
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
2. Дана схема превращений: 
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение реакции.
3. Дана схема превращений: 
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
4. Дана схема превращений: 
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
5. Дана схема превращений: 
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
6. Дана схема превращений: 
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
7. Дана схема превращений: 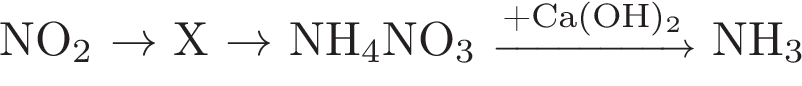
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
8. Дана схема превращений: 
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для первого превращения составьте сокращённое ионное уравнение реакции.
9. Дана схема превращений: 
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
10. Дана схема превращений: 
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращенное ионное уравнение реакции.
Ответы:
Задание 1.

1) Na2S + FeCl2 = 2NaCl + FeS↓
2) FeS + 2HCl = H2S↑ + FeCl2
3) 2H2S + 3O2 = 2SO2↑ + 2H2O
4) Составим сокращенное ионное уравнение Fe2+ + S2- = FeS↓
Задание 2.

1) BaO + 2HCl = BaCl2 + H2O
2) BaCl2 + Na2CO3 = BaCO3↓ + 2NaCl
3) BaCO3 + 2HNO3 = Ba(NO3)2 + CO2↑ + H2O
4) Составим сокращенное ионное уравнение Ba2+ + CO32- = BaCO3↓
Задание 3.

1) FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
2) Fe(OH)3 + 3HBr = FeBr3 + 3H2O
3) FeBr3 + 3KOH = Fe(OH)3↓ + 3KBr
4) Составим сокращенное ионное уравнение Fe3+ + 3OH- = Fe(OH)3↓
Задание 4.

1) 4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑
2) SO2 + H2O = H2SO3
3) H2SO3 + CaO = CaSO3↓ + H2O
4) Составим сокращенное ионное уравнение H2SO3 + CaO = CaSO3↓ + H2O
Задание 5.

1) FeCl2 + 2KOH = Fe(OH)2↓ + 2KCl
2) Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
3) FeSO4 + Zn = ZnSO4 + Fe
4) Составим сокращенное ионное уравнение Fe2+ +2OH- = Fe(OH)2↓
Задание 6.

1) 2Na + O2 = Na2O2
2) 2Na2O2 + 2H2O = 4NaOH + O2↑
3) 3NaOH + H3PO4 = Na3PO4 + 3H2O
4) Составим сокращенное ионное уравнение H3PO4 + 3OH- = PO43- + 3H2O
Задание 7.
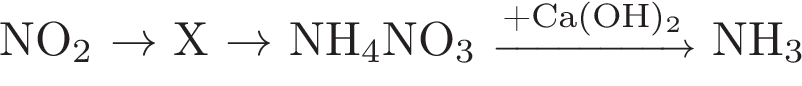
1) 4NO2 + O2 + 2H2O = 4HNO3
2) HNO3 + NH3 = NH4NO3
3) 2NH4NO3 + Ca(OH)2 = 2NH3↑ + Ca(NO3)2 + 2H2O
4) Составим сокращенное ионное уравнение NH4+ + OH- = NH3↑+ H2O
Задание 8.

1) Al(NO3)3 + 3NaOH = Al(OH)3↓ + 3NaNO3
2) 2Al(OH)3 = Al2O3 + 3H2O
3) Al2O3 + Na2O = 2NaAlO2
4) Составим сокращенное ионное уравнение Al3+ + 3OH- = Al(OH)3↓
Задание 9.

1) CuO + H2SO4 = CuSO4 + H2O
2) CuSO4 + Ba(NO3)2 = BaSO4↓ + Cu(NO3)2
3) Cu(NO3)2 + 2NaOH = Cu(OH)2↓ + 2NaNO3
4) Составим сокращенное ионное уравнение Cu2+ + 2OH- =Cu(OH)2↓
Задание 10.

1) Fe + 2HCl = FeCl2 + H2↑ (Х – любая растворимая соль Fe2+)
2) FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl
3) Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
4) Составим сокращенное ионное уравнение Fe2+ +2OH- = Fe(OH)2↓
22 Вычисление количества вещества, массы или объема вещества по количеству вещества, массе или объему одного из реагентов или продуктов реакции. Вычисление массовой доли растворенного вещества в растворе
Задание № 22 направлено на проверку умения вычислять массовую долю растворенного вещества в растворе, количество вещества, массу или объем вещества по количеству вещества, массу или объем одного из реагентов или продуктов реакции.
Перед выполнением предложенных заданий повторите:
Массовая доля (ώ) – это отношение массы этого вещества к массе раствора
m (раствора) = m (растворенного вещества) + (m растворителя)
ώ (растворенного вещества) = 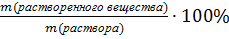
m = 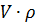
Пример 1. К 250 г раствора карбоната натрия добавляли раствор хлорида бария до прекращения выделения осадка. Масса отфильтрованного и высушенного осадка составила 39,4 г. Рассчитайте массовую долю карбоната натрия в исходном растворе.
| Содержание верного ответа |
| 1) Составляем уравнение реакции: Na2CO3 + BaCl2 = 2NaCl + BaCO3↓ 2) Рассчитываем количество вещества и массу карбоната натрия, содержащегося в растворе: n(BaCO3) = m/M = 39,4/197 = 0,2 (моль) n(BaCO3) = n (Na2CO3) по уравнению реакции m(Na2CO3) = M ∙ n = 106 ∙ 0,2 = 21,2 (г) 3) Вычисляем массовую долю карбоната натрия в исходном растворе: ώ(Na2CO3) = m (Na2CO3)/ m(раствора) = 21,2/250 = 0,085 или 8,5% |
Пример 2. При взаимодействии 8,0 г оксида серы (VI) с избытком раствора гидроксида калия получили 174 г раствора средней соли. Вычислите массовую долю соли в полученном растворе.
| Содержание верного ответа |
| 1) Составляем уравнение реакции: SO3 + 2KOH = K2SO4 + H2O 2) Рассчитываем количество вещества и массу сульфата калия, образовавшегося в результате реакции: n(SO3) = m/M = 8/80 = 0,1 (моль) n(K2SO4) = n (SO3) по уравнению реакции m(K2SO4) = M ∙ n = 174 ∙ 0,1 = 17,4 (г) 3) Вычисляем массовая доля сульфата калия в образовавшемся растворе: ώ(K2SO4) = m (K2SO4)/ m(раствора) = 17,4/174 = 0,1 или 10% |
Пример 3. При сжигании сульфида железа (II) на воздухе образовалось 32 г оксида железа (III). Какой объём воздуха (н.у.) для этого потребовался? Объёмная доля кислорода в воздухе составляет 21 %.
| Содержание верного ответа |
1) Составляем уравнение реакции:
4FeS +7O2 = 2Fe2O3 + 4SO2↑
2) Рассчитываем количество вещества и объём кислорода затраченного на сжигание
n(Fe2O3) = m/M = 32/160 = 0,2 (моль)
n(O2) = 3,5 n (Fe2O3) по уравнению реакции, то есть 0,7 моль
V(O2) = Vm ∙ n = 22,4 ∙ 0,7 = 15,68 (л)
3) Вычисляем объём воздуха необходимого для горения:
m(воздуха) = V (O2) / 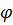 (O2)= 15,68/0,21 = 74,6 (л) (O2)= 15,68/0,21 = 74,6 (л)
|
 2020-09-24
2020-09-24 234
234








