1.На какой диаграмме распределение массовых долей элементов соответствует MgSO4?

2.На какой диаграмме распределение массовых долей элементов соответствует количественному составу сульфата лития?
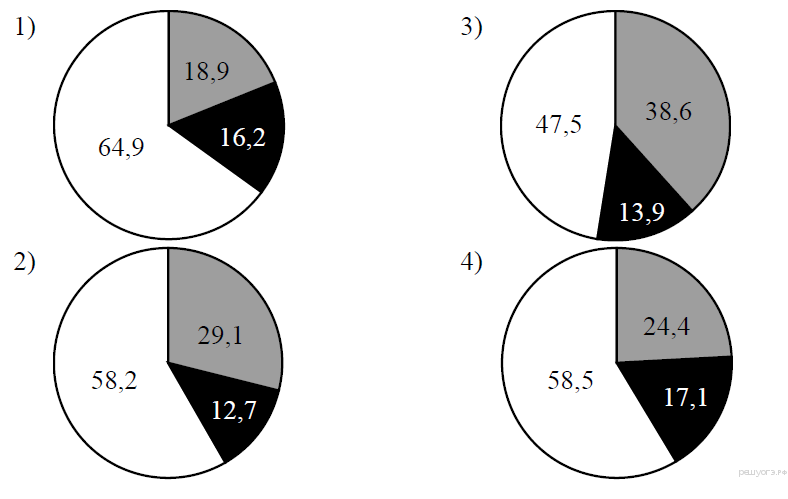
3.На какой диаграмме распределение массовых долей элементов соответствует количественному составу сульфата железа (II)?

4.На какой диаграмме правильно показаны массовые доли элементов в KNO3?
 1) 1 2) 2 3) 3 4) 4
1) 1 2) 2 3) 3 4) 4
5.На какой диаграмме распределение массовых долей элементов соответствует MgCO3?

6.Массовая доля кислорода в сульфате алюминия равна
1) 4,7% 2) 12,8% 3) 56,1% 4) 16,0%
7.На какой диаграмме распределение массовых долей элементов соответствует CaCO3?


8.Массовая доля серы в сульфатe железа (III) равна
1) 24,0% 2) 32,0% 3) 8,0% 4) 33,3%
9.Массовая доля углерода в карбонате аммония равна
1) 14,6% 2) 8,3% 3) 4,2% 4) 12,5%
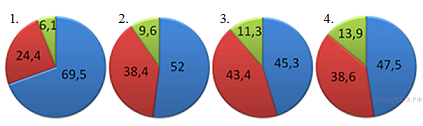
10.На какой диаграмме распределение массовых долей элементов соответствует количественному составу карбоната цинка?
Ответы:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 3 | 2 | 4 | 2 | 3 | 3 | 4 | 1 | 4 | 2 |
Часть 2
Задание 20 Окислитель. Восстановитель. Окислительно – восстановительные реакции
Задание № 20 направлено на проверку умения определять степень окисления химических элементов, окислитель и восстановитель, составлять электронный баланс и на его основе расставлять коэффициенты в уравнении реакции.
Перед выполнением предложенных заданий повторите:
· Окислительно - восстановительные реакции — это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Алгоритм действий выглядит следующим образом:
· Вычисляем изменение степени окисления каждого элемента в уравнении химической реакции;
· Выбираем только те элементы, которые поменяли степень окисления;
· Для найденных элементов составляем электронный баланс, заключающийся в подсчете количества приобретенных или отданных электронов;
· Находим наименьшее общее кратное для переданных электронов;
· Полученные значения и есть коэффициенты в уравнении (за редким исключением).
Задание
1. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой:
Сu2O + H2SO4 = CuSO4+ SO2 + H2O
Определите окислитель и восстановитель.
Решение:
1. Cu+1 – 1e→ Cu+2 ½1 Cu +1 - восстановитель
S+6 + 2e→ S+4 | 2 S+6 - окислитель
Сu2O + 3H2SO4 = 2CuSO4+ SO2 + 3H2O
 2020-09-24
2020-09-24 622
622








