1. В синтезе пуриновых нуклеотидов участвуют:
а) метил-Н4-фолат;
б) глицин;
в) метилен-Н4-фолат;
г) аланин;
д) аспарагин.
2. ФРДФ:
а) образуется при взаимодействии рибозо-5-фосфата и АТФ;
б) участвует в превращении уридина в УМФ;
в) является одним из субстратов синтеза мочевой кислоты;
г) участвует в превращении ОМФ в УМФ;
д) образуется в реакции, катализируемой ГМФ-синтетазой.
3. Регуляторный фермент в синтезе пиримидиновых нуклеотидов de novo:
а) карбамоилфосфатсинтетаза II;
б) дигидрофолатредуктаза;
в) НМФ-киназа;
г) ОМФ-декарбоксилаза;
д) рибонуклеотидредуктаза.
4. Гиперурикемия и подагра наблюдаются при:
а) оротацидурии;
б) атеросклерозе;
в) синдроме Леша-Нихена;
г) гиперкортицизме;
д) фенилкетонурии.
5. 5-фторурацил - ингибитор:
а) дигидрофолатредуктазы;
б) рибонуклеотидредуктазы;
в) карбамоилфосфатсинтетазы II;
г) тимидилатсинтазы;
д) оротатфосфорибозилтрансферазы.
6. Ингибитор тимидилатсинтазы:
а) метотрексат;
б) аминоптерин;
в) метилен-Н4-фолат;
г) азидотимидин;
д) 5-фторурацил.
7. При недостаточности УМФ-синтазы развивается:
а) подагра;
б) синдром Леша-Нихена;
в) оротацидурия;
г) мочекаменная болезнь;
д) болезнь Гирке.
8. Для лечения оротацидурии используют:
а) 5-фторурацил;
б) оротат;
в) уридин;
г) тимидин;
д) карбамоиласпартат.
9. Выберите реакцию, которая способна ликвидировать «пиримидиновый» голод при оротацидурии:
а) дигидроротат + NAD+ → оротат + NADH + H+;
б) тимидин + АТФ → ТМФ + АДФ;
в) уридин + Н3РО4 → урацил + рибозо-5-фосфат;
г) уридин + АТФ → УМФ + АДФ;
д) гуанозин + АТФ → ГМФ + АДФ.
10. Недостаточность какого фермента может привести к клеточному и гуморальному иммунодефициту:
а) ксантиноксидаза;
б) пуриннуклеозидфосфорилаза;
в) аденозиндезаминаза;
г) гипоксантин-гуанинфосфорибозилтрансфераза;
д) гуаназа.
11. При клеточном и гуморальном иммунодефиците снижена скорость реакции:
а) аденозин + Н2О → инозин + NH3;
б) гуанозин + Н3РО4 → гуанин + рибозо-1-фосфат;
в) гуанин + Н2О → ксантин + NH3;
г) гипоксантин + О2 + Н2О → ксантин + Н2О2;
д) ксантин + О2 + Н2О → мочевая кислота + Н2О2.
12. Снижение активности аденозиндезаминазы приводит к:
а) снижению активности амидофосфорибозилтрансферазы;
б) гиперурикемии, вызванной снижением повторного использования пуриновых оснований;
в) накоплению дГТФ, который ингибирует рибонуклеотидредуктазу в Т-лимфоцитах;
г) активации НМФ- и НДФ-киназ;
д) увеличению концентрации дАТФ, который ингибирует рибонуклеотидредуктазу в В- и Т-лимфоцитах.
13. Регуляторные реакции синтеза пуриновых нуклеотидов de novo:
а) обеспечивают контроль использования ИМФ на синтез АМФ и ГМФ;
б) предотвращают избыточное образование ФРДФ;
в) контролируют синтез АМФ путем ингибирования аденилосукциназы;
г) катализируют образование сбалансированного количества АТФ и ГТФ;
д) ингибируют синтез ГМФ с помощью АТФ.
14. В метаболическом пути синтеза пиримидиновых нуклеотидов de novo:
а) карбамоилфосфат образуется из аммиака, СО2 и 2 АТФ;
б) карбамоилфосфат и аспартат взаимодействуют с образованием карбамоиласпартата;
в) при циклизации карбамоиласпартата и его дегидрировании синтезируется оротат;
г) УМФ образуется при декарбоксилировании оротата;
д) ОМФ - продукт фосфорилирования оротата АТФ.
15. Гипоксантин-гуанинфосфорибозилтрансфераза:
а) возвращает гуанин и гипоксантин в фонд нуклеотидов;
б) превращает аденин в АМФ;
в) часто малоактивна у пациентов, страдающих гиперурикемией;
г) неактивна у мальчиков с синдромом Леша-Нихена;
д) участвует в ресинтезе нуклеотидов из нуклеозидов по «запасным путям».
16. Регуляторные ферменты в синтезе пуриновых нуклеотидов:
а) ФРДФ-синтетаза;
б) аденилосукцинатсинтетаза;
в) амидофосфорибозилтрансфераза;
г) ИМФ-дегидрогеназа;
д) ГМФ-синтетаза.
17. Аллопуринол:
а) ингибитор ксантиноксидазы;
б) превращаясь в нуклеотид, ингибирует ФРДФ-синтетазу;
в) предотвращает развитие подагры;
г) увеличивает выведение мочевой кислоты;
д) повышает концентрацию гипоксантина в моче.
18. Причиной гиперурикемии может быть:
а) суперактивация ФРДФ-синтетазы;
б) устойчивость амидофосфорибозилтрансферазы к ретроингиби-рованию;
в) снижение активности ксантиноксидазы;
г) снижение скорости реутилизации пуриновых оснований;
д) недостаточность пуриннуклеозидфосфорилазы.
19. Аллопуринол используют в лечении:
а) мегалобластной анемии;
б) подагры;
в) гуморального иммунодефицита;
г) оротацидурии;
д) синдрома Леша-Нихена.
20. Для синтеза дезоксирибонуклеотидов требуется:
а) субстраты - 4 НТФ;
б) рибонуклеотидредуктаза;
в) низкомолекулярный белок - тиоредоксин;
г) тиоредоксинредуктаза;
д) NADPH + H+.
21. В синтезе дТМФ участвуют:
а) дУМФ;
б) метил-Н4-фолат;
в) метилен-Н4-фолат;
г) метенил-Н4-фолат;
д) тимидилатсинтаза.
22. К пронумерованным на рисункам атомам углерода пурина подберите субстраты:
а) метенил-Н4-фолат;
б) формил-Н4-фолат;
в) глицин;
г) СО2;
д) метилен- Н4-фолат.

Ответ: 1 - г, 2 - б, 3 – в.
23. К пронумерованным на рисунке атомам азота аденина подберите субстраты:
а) α-NH2-группа Асп;
б) амидная группа Глн;
в) α-NH2-группа Гли;
г) NH3;
д) α-NH2-группа Глу.
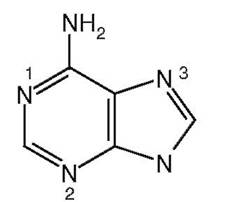
Ответ: 1 - а, 2 - б, 3 – в.
24. К реакциям синтеза пуриновых нуклеотидов подберите недостающие компоненты:
Реакции:
1. Глн +? → 5-фосфорибозиламин + Глу + Н4Р2О7.
2.? + АТФ → ФРДФ + АМФ.
3. ИМФ + аспартат +?→ аденилосукцинат + ГДФ + Н3РО4.
Субстраты:
а) Рибозо-5-фосфат;
б) АТФ;
в) ГТФ;
г) ФРДФ;
д) ИМФ.
Ответ: 1 - г, 2 - а, 3 – в.
25. К реакциям синтеза пиримидиновых нуклеотидов подберите недостающие компоненты:
Реакции:
1. Оротат +?→ ОМФ + Н4Р2О7.
2. СО2 + Глн + 2 АТФ →? + 2 АДФ + Н3РО4.
3.? → дигидрооротат + Н2О.
Субстраты или продукты:
а) ФРДФ;
б) карбамоилфосфат;
в) карбамоиласпартат;
г) ЦТФ;
д) УМФ.
Ответ: 1 - а, 2 - б, 3 – в.
26. К реакциям синтеза пиримидиновых нуклеотидов подберите недостающие компоненты:
Реакции:
1. ОМФ →? + СО2.
2. Дигидрооротат +? → оротат.
3. УТФ + Глн + АТФ →? + Глу + АДФ + Н3РО4.
Субстраты или продукты:
а) ЦТФ;
б) УМФ;
в) NAD+;
г) АТФ;
д) NADР+.
Ответ: 1 - б, 2 - в, 3 – а.
27. К реакциям обмена нуклеотидов подберите соответствующие субстраты или кофакторы:
Субстраты или кофакторы:
1. Используют тиоредоксин в качестве кофактора.
2. Глн и АТФ участвуют в аминировании УТФ.
3. О2 участвует в окислении азотистых оснований.
Процессы:
а) синтез АМФ и ГМФ из ИМФ;
б) синтез УМФ из оротата;
в) образование ЦТФ из УТФ;
г) превращение пуринов в мочевую кислоту;
д) восстановление НДФ до дНДФ.
Ответ: 1 - д, 2 - в, 3 – г.
28. К перечисленным реакциям обмена нуклеотидов подберите соответствующие ферменты:
Реакции:
1. Осуществляет синтез дНДФ из НДФ.
2. В регенерации активной формы белка использует NADPH.
3. Катализирует образование метилен-Н4-фолата.
Ферменты:
а) рибонуклеотидредуктаза;
б) тимидилатсинтаза;
в) ЦТФ-синтаза;
г) тиоредоксинредуктаза;
д) сериноксиметилтрансфераза.
Ответ: 1 - а, 2 - г, 3 – д.
29. К перечисленным процессам подберите участвующие в них нуклеотиды или их прозводные:
Процессы:
1. Активация протеинкиназы А.
2. Синтез гликогена.
3. Реакции трансметилирования.
Нуклеотиды и их производные:
а) S-аденозилметионин;
б) дТТФ;
в) УДФ-глюкоза;
г) ФАД;
д) цАМФ.
Ответ: 1 - д, 2 - в, 3 – а.
Тема: «Энзимология»
1. Ферменты, в отличие от небелковых катализаторов:
а) соединяются с субстратом обратимо;
б) не изменяют состояния равновесия реакции;
в) после реакции обнаруживаются в неизмененном виде и количестве;
г) уменьшают энергию активации;
д) узнают свой субстрат при наличии множества других соединений.
2. Ферменты, обладающие относительной субстратной специфичностью:
а) присоединяют субстрат ковалентно в активном центре;
б) катализируют только одно превращение субстрата из всех возможных;
в) катализируют один тип реакции с более чем одним структурно подобным субстратом;
г) взаимодействуют только с одним субстратом;
д) ускоряют несколько превращений со структурно похожими субстратами.
3. Глюкокиназа, в отличие от гексокиназы:
а) имеет более высокое сродство к глюкозе;
б) катализирует реакцию: Глюкоза + АТФ → Глюкозо-6-фосфат + АДФ;
в) содержится в клетках многих органов;
г) имеет более высокое значение Km;
д) катализирует обратимую реакцию.
4. Структура на рис. 2.1 - компонент кофермента:
а) биотина;
б) FAD;
в) NAD +;
г) пиридоксальфосфата;
д) кофермент A (HSKoA).
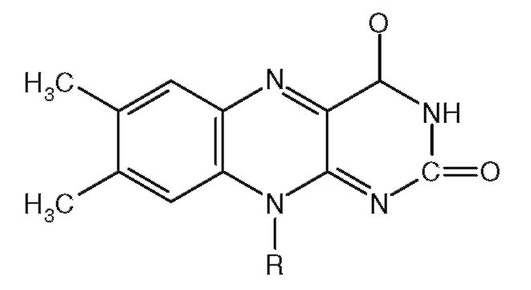
Рис. 2.1.
5. Структура на рис. 2.2 - компонент кофермента:
а) биотина;
б) FAD;
в) NAD +;
г) пиридоксальфосфата;
д) кофермент A (HSKoA).
6. Структура на рис. 2.3 - компонент кофермента:
а) биотина;
б) FAD;
в) NAD +;
г) пиридоксальфосфата;
д) кофермент A (HSKoA).
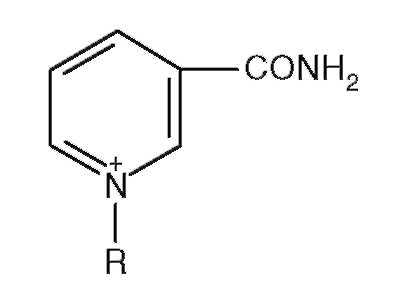
Рис. 2.2.
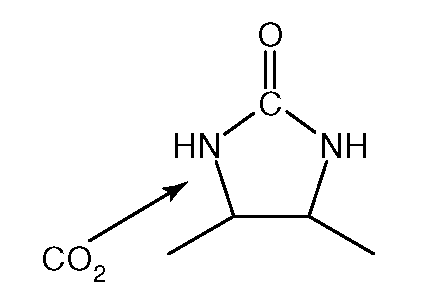
Рис. 2.3.
7. Структура на рис. 2.4 - компонент кофермента:
а) биотина;
б) FAD;
в) NAD +;
г) пиридоксальфосфата;
д) кофермент A (HSKoA).
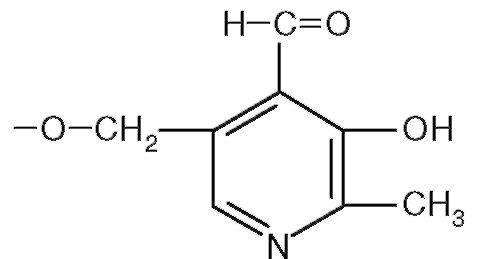
Рис. 2.4.
8. При завершении ферментативного катализа:
а) кофермент комплементарно связывается с ферментом;
б) субстрат приближается к активному центру фермента;
в) происходит дестабилизация связей в субстрате;
г) возникает индуцированное соответствие между активным центром фермента и субстратом;
д) продукты выходят из области активного центра.
9. Киназы катализируют превращения:
а) перенос групп внутри молекулы;
б) перенос фосфатной группы от молекулы донора к акцептору;
в) образование C-O-связей;
г) разрыв C-C-связей;
д) присоединение воды.
10. Протеинкиназы, в отличие от протеинфосфатаз:
а) катализируют реакцию: Белок-OH + АТФ → Белок-ОР03Н2 + АДФ;
б) влияют на количество фосфорилированных белков в клетке;
в) изменяют активность ферментов в ответ на действие гормона;
г) катализируют реакцию: Белок-ОР03Н2 + H2O → Белок-OH + Н3РO4;
д) изменяют количество дефосфорилированных белков в клетке.
11. Утверждение, правильно характеризующее удельную активность ферментов:
а) количество фермента, которое образует 1 моль продукта в секунду;
б) количество фермента, которое образует 1 моль продукта в секунду при стандартных значениях
в) количество фермента, катализирующее превращение 1 мкмоль субстрата за 1 мин;
г) активность фермента в присутствии наиболее предпочтительного субстрата;
д) количество единиц активности фермента в 1 мг белка.
12. Протекание реакции на рис. 2.5 нарушается при недостатке витамина:
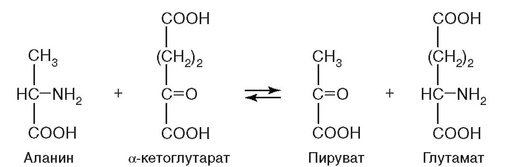
Рис. 2.5.
а) B1;
б) B2;
в) B6;
г) PP;
д) биотина.
13. Протекание реакции на рис. 2.6 нарушается при недостатке витамина:
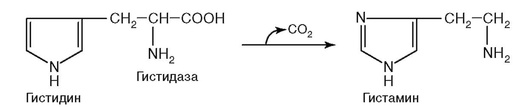
Рис. 2.6.
а) B1;
б) B2;
в) B6;
г) PP;
д) биотина.
14. Протекание реакции на рис. 2.7 нарушается при недостатке витамина:
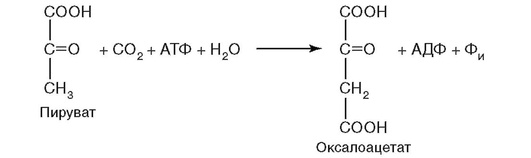
Рис. 2.7.
а) B1;
б) B2;
в) B6;
г) PP;
д) биотина.
15. К какому классу относится фермент, катализирующий реакцию (рис. 2.8) превращения аминокислоты глутамата в ГАМК (тормозной медиатор ЦНС)?
а) оксидоредуктаза;
б) трансфераза;
в) изомераза;
г) лиаза;
д) лигаза.
16. К какому классу относится фермент, катализирующий реакцию (рис. 2.9) превращения сукцината в фумарат?
а) оксидоредуктаза;
б) трансфераза;
в) изомераза;
г) гидролаза;
д) лиаза.
17. К какому классу относится фермент, катализирующий реакцию превращения этанола в печени в токсичный метаболит - ацетальдегид (СН3СН2ОН → СН3СНО)?
а) оксидоредуктаза;
б) трансфераза;
в) изомераза;
г) гидролаза;
д) лиаза.
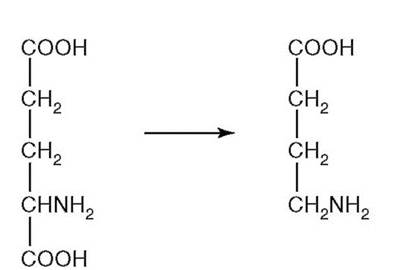
Рис. 2.8.
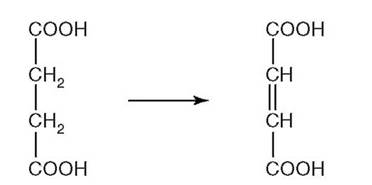
Рис. 2.9.
18. К какому классу относится фермент, катализирующий реакцию превращения жира (рис. 2.10)?

Рис. 2.10.
а) оксидоредуктаза;
б) трансфераза;
в) изомераза;
г) гидролаза;
д) лиаза.
19. К какому классу относится фермент, катализирующий реакцию активации глюкозы (глюкоза + ATO → глюкозо-6-фосфат + ЛДФ)?
а) оксидоредуктаза;
б) трансфераза;
в) изомераза;
г) гидролаза;
д) лиаза.
20. К какому классу относится фермент, катализирующий реакцию протеолиза (рис. 2.11)?
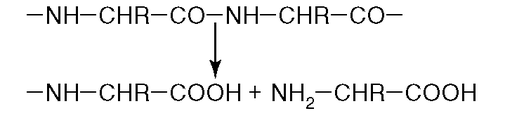
Рис. 2.11.
а) оксидоредуктаза;
б) трансфераза;
в) изомераза;
г) гидролаза;
д) лиаза.
21. К какому классу относится фермент, катализирующий реакцию метаболического пути распада глюкозы (рис. 2.12)?
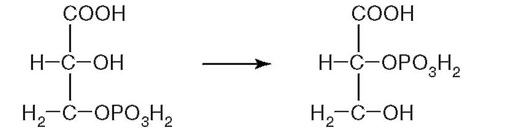
Рис. 2.12.
а) оксидоредуктаза;
б) трансфераза;
в) изомераза;
г) гидролаза;
д) лиаза.
22. К какому классу относится фермент, катализирующий реакцию, важную для запасания энергии в клетках (креатин + АТФ → креатинфосфат +АДФ)?
а) оксидоредуктаза;
б) трансфераза;
в) изомераза;
г) гидролаза;
д) лиаза.
23. К какому классу относится фермент, катализирующий реакцию, важную для завершения проведения сигнала ацетилхолина в нервно-мышечных синапсах (рис. 2.13)?
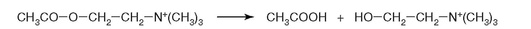
Рис. 2.13.
а) оксидоредуктаза;
б) трансфераза;
в) изомераза;
г) гидролаза;
д) лиаза.
24. К какому классу относится фермент, катализирующий конечную реакцию распада глюкозы в клетках при гипоксии (рис. 2.14)?
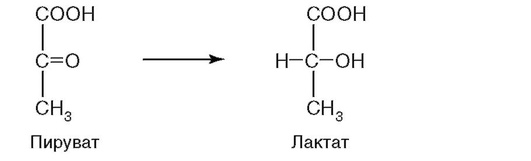
Рис. 2.14.
а) оксидоредуктаза;
б) трансфераза;
в) изомераза;
г) гидролаза;
д) лиаза.
25. Конкурентные ингибиторы:
а) образуют ковалентные связи с активным центром фермента;
б) взаимодействуют с аллостерическим центром;
в) взаимодействуют с активным центром фермента, образуя слабые связи;
г) уменьшают Km;
д) уменьшают Vmax.
26. Необратимые ингибиторы:
а) структурные аналоги субстрата;
б) образуют с ферментом ковалентные связи;
в) образуют с ферментом слабые связи;
г) взаимодействуют с регуляторным центром;
д) снижают ингибирующий эффект при увеличении концентрации субстрата.
27. Ацетилсалициловая кислота по механизму действия:
а) обратимый ингибитор;
б) необратимый ингибитор;
в) структурный аналог субстрата;
г) вызывает конкурентное ингибирование активности фермента;
д) относится к антиметаболитам.
28. Конкурентные ингибиторы ферментов изменяют:
а) Vmax катализируемой реакции;
б) Km реакции;
в) Vmaxи Kmреакции;
г) специфичность к субстрату;
д) первичную структуру фермента.
29. Лекарственный препарат неостигмина метилсульфат (прозерин♠):
а) увеличивает активность АХЭ;
б) связывается в аллостерическом центре фермента;
в) образует с ферментом ковалентную связь;
г) ингибирует ферменты с остатком серина в активном центре;
д) является обратимым ингибитором.
30. Сульфаниламидные препараты по структуре являются аналогами:
а) глутаминовой кислоты;
б) ацетилхолина;
в) цАМФ;
г) фолиевой кислоты;
д) ПАБК.
31. Лекарства - ингибиторы ферментов:
а) исключительно необратимые ингибиторы;
б) взаимодействуют с ферментом только в активном центре;
в) уменьшают активность фермента;
г) взаимодействуют со всеми ферментами;
д) изменяют структуру образованного продукта.
32. ДФФ:
а) конкурентный ингибитор АХЭ;
б) структурный аналог субстрата протеаз;
в) лекарство, используемое для лечения глаукомы;
г) специфический необратимый ингибитор сериновых ферментов;
д) обратимо связывается с ОН-группой серина в активном центре ферментов.
33. Апротинин:
а) обратимый ингибитор АХЭ;
б) используется при парезах и параличах;
в) пептид;
г) активатор трипсиногена;
д) протеаза.
34. Апротинин:
а) конкурентный ингибитор трипсиногена;
б) специфический необратимый ингибитор трипсина;
в) структурный аналог ацетилхолина;
г) используется для лечения острого панкреатита;
д) фермент, активатор трипсиногена.
35. По механизму частичного протеолиза активируется фермент:
а) ЛДГ;
б) пепсин;
в) КК;
г) аспарагиназа;
д) щелочная фосфатаза.
36. Причина активации пепсина:
а) изменение рН;
б) отщепление субъединиц;
в) фосфорилирование;
г) изменение первичной структуры;
д) метилирование.
37. Пример необратимой регуляции активности ферментов:
а) фосфорилирование под действием протеинкиназ;
б) аллостерическая регуляция;
в) дефосфорилирование под действием протеинфосфатаз;
г) присоединение к ферменту белка-регулятора;
д) частичный протеолиз ферментов.
38. К активации аллостерических ферментов приводит:
а) химическая модификация фермента;
б) гидролиз пептидных связей;
в) кооперативное взаимодействие субъединиц;
г) диссоциация протомеров при разрыве слабых связей;
д) фосфорилирование молекулы фермента.
39. Для аллостерически регулируемых ферментов характерно:
а) олигомерное строение;
б) мономерное строение;
в) изменение первичной структуры при активации;
г) присоединение молекулы-регулятора в активный центр;
д) регуляция активности химической модификацией.
40. Ферменты с аллостерической регуляцией:
а) активируются под действием протеинкиназ;
б) имеют каталитический и регуляторный центры, локализованные на разных протомерах;
в) в результате активации меняют первичную структуру;
г) снижают активность присоединением регуляторной субъединицы;
д) активируются под действием протеинфосфатаз.
41. Протеинкиназы:
а) катализируют реакцию фосфорилирования белков;
б) катализируют реакцию дефосфорилирования белков;
в) аллостерические ферменты;
г) относятся к классу ферментов лигаз;
д) относятся к классу ферментов гидролаз.
42. Для увеличения концентрации цАМФ можно использовать:
а) ингибиторы фосфодиэстеразы;
б) ингибиторы аденилатциклазы;
в) ингибиторы протеинкиназы А;
г) активаторы фосфодиэстеразы;
д) активаторы протеинфосфатазы.
43. Концентрация цАМФ в клетке:
а) снижается при действии на клетку теофиллина;
б) уменьшается при активации аденилатциклазы;
в) увеличивается при активации фосфодиэстеразы;
г) увеличивается при действии на клетку кофеина;
д) уменьшается при активации протеинкиназы А.
44. Фермент аденилатциклаза:
а) активирует фосфодиэстеразу;
б) не влияет на концентрацию цАМФ в клетке;
в) катализирует образование цАМФ;
г) вызывает гидролиз цАМФ;
д) ингибируется под действием протеинкиназы А.
45. По механизму белок-белковых взаимодействий активируется фермент:
а) пепсин;
б) протеинкиназа А;
в) КК;
г) щелочная фосфатаза;
д) аспарагиназа.
46. По механизму белок-белковых взаимодействий активируется фермент:
а) трипсин;
б) аспарагиназа;
в) аденилатциклаза;
г) фосфодиэстераза;
д) АХЭ.
47. По механизму фосфорилирования-дефосфорилирования регулируется фермент:
а) аденилатциклаза;
б) пепсин;
в) КК;
г) гликогенфосфорилаза;
д) аспарагиназа.
48. Аллостерической регуляции подвергается фермент:
а) аденилатциклаза;
б) протеинкиназа А;
в) фосфофруктокиназа;
г) уреаза;
д) аспарагиназа.
49. Ферменты используются в клинико-диагностических лабораториях:
а) для рассасывания рубцов;
б) в качестве аналитического реактива;
в) в качестве лечебного препарата;
г) для очистки гнойных ран;
д) для лечения опухолевых заболеваний.
50. Для диагностики рака предстательной железы в крови определяют активность фермента:
а) уреазы;
б) липазы;
в) ЛДГ;
г) сукцинатдегидрогеназы;
д) кислой фосфатазы.
51. Фермент гиалуронидаза используется в медицине для:
а) удаления токсинов;
б) лечения злокачественных образований;
в) рассасывания рубцов;
г) улучшения пищеварения;
д) предотвращения тромбообразования.
52. Фермент пепсин используется в медицине для:
а) обработки гнойных ран;
б) предотвращения тромбообразования;
в) улучшения пищеварения;
г) рассасывания рубцов;
д) лечения вирусного конъюнктивита.
53. Фермент α-амилаза используется в энзимодиагностике заболевания:
а) сердца;
б) поджелудочной железы;
в) печени;
г) простаты;
д) мозга.
54. В первые сутки после инфаркта миокарда в крови больных больше всего возрастает активность фермента:
а) КК;
б) ЛДГ;
в) АЛТ;
г) АСТ;
д) щелочной фосфатазы.
55. Для лечения лейкозов используют фермент:
а) пепсин;
б) трипсин;
в) урокиназу;
г) аспарагиназу;
д) уреазу.
56. Ферменты, в отличие от небиологических катализаторов:
а) очень чувствительны к небольшим изменениям pH;
б) не расходуются в процессе химической реакции;
в) как правило, не теряют каталитических свойств при высоких температурах;
г) обладают способностью к регуляции;
д) обладают высокой эффективностью действия.
57. Ферменты, так же как и небиологические катализаторы:
а) ускоряют энергетически возможные реакции;
б) изменяют энергию химической системы;
в) не расходуются в процессе реакции;
г) не изменяют направления реакции;
д) обладают специфичностью действия.
58. Ферменты, в отличие от небиологических катализаторов:
а) обладают высокой эффективностью действия;
б) действуют в клетке при мягких физиологических условиях;
в) способны к регуляции;
г) в ходе реакции расходуются;
д) обладают высокой специфичностью.
59. Активный центр фермента:
а) формируется из радикалов аминокислот, сближенных на уровне третичной структуры;
б) специфично связывает субстрат;
в) образует ковалентные связи с молекулой субстрата;
г) всегда содержит простетическую группу;
д) катализирует химическое превращение субстрата.
60. Активный центр фермента:
а) непосредственно взаимодействует с субстратом и участвует в катализе;
б) комплементарен субстрату;
в) всегда соединяется только с одним-единственным субстратом;
г) составляет относительно небольшую часть молекулы фермента;
д) состоит только из полярных аминокислот.
61. Ферменты, обладающие абсолютной субстратной специфичностью:
а) катализируют один тип реакции с несколькими сходными субстратами;
б) имеют конформацию активного центра, способную к небольшим изменениям;
в) катализируют превращение только одного-единственного субстрата;
г) связывают субстрат с активным центром комплементарно;
д) способны взаимодействовать со стереоизомерами субстрата.
62. Ферменты, обладающие групповой субстратной специфичностью:
а) катализируют один тип реакции с несколькими сходными субстратами;
б) имеют «гибкую» конформацию активного центра;
в) ускоряют единственную реакцию;
г) связывают субстрат комплементарно;
д) взаимодействуют только с определенным стереоизомером субстрата.
63. Ферменты, катализирующие однотипные реакции с небольшим количеством структурно похожих субстратов:
а) трипсин;
б) липаза;
в) уреаза;
г) аргиназа;
д) карбоангидраза.
64. Специфичность пути превращения:
а) обусловлена комплементарностью субстрата активному центру фермента;
б) обеспечивает превращение вещества в определенном метаболическом пути;
в) предусматривает взаимодействие фермента только с одним определенным субстратом;
г) зависит от конформации активного центра;
д) предусматривает возможность превращения группы подобных субстратов.
65. Ферменты, активный центр которых комплементарен только одному субстрату:
а) трипсин;
б) липаза;
в) уреаза;
г) аргиназа;
д) химотрипсин.
66. Сериновые протеазы:
а) ускоряют гидролиз пептидных связей в белках;
б) вызывают денатурацию белков;
в) проявляют абсолютную специфичность к субстрату;
г) представлены трипсином, химотрипсином, эластазой;
д) проявляют групповую специфичность к субстрату.
67. Сериновые протеазы:
а) имеют одинаковую первичную структуру;
б) имеют в активном центре триаду аминокислот Асп, Гис и Сер;
в) взаимодействуют только с определенным субстратом;
г) ускоряют гидролиз пептидных связей в самых разных белках;
д) имеют похожую пространственную структуру и общий каталитический механизм.
68. Для сериновых протеаз характерно:
а) однотипное строение каталитического участка активного центра;
б) участие в протеолизе триады аминокислот Асп, Гис и Сер;
в) групповая специфичность к субстратам;
г) однотипное строение субстрат-связывающего участка активного центра.
д) разная первичная структура.
69. Константа Михаэлиса (Км):
а) параметр кинетики ферментативных реакций;
б) может иметь разное значение для изоферментов;
в) концентрация субстрата, при которой достигается половина максимальной скорости (Vmax) ферментативной реакции;
г) коэффициент для расчета Vmax;
д) сродство фермента к субстрату прямо пропорционально Km.
70. Холоферменты:
а) сложные ферменты;
б) содержат коферменты - производные витаминов;
в) обладают специфичностью, которая определяется белковой частью;
г) имеют в составе простетическне группы, которые легко отделяются от белка;
д) комплементарно связывают как субстрат, так и кофермент.
71. Апофермент:
а) органическое соединение, в состав которого входит производное витамина;
б) белковая часть холофермента;
в) обладает каталитической активностью;
г) имеет участок, комплементарный субстрату;
д) образует комплекс с коферментом.
72. Апофермент:
а) комплекс белка и кофактора;
б) обладает высокой каталитической активностью;
в) неорганический ион или органическое соединение, производное витамина;
г) обладает низкой активностью, часто вообще неактивен;
д) белковая часть холофермента.
73. Кофермент:
а) небелковая часть молекулы холофермента;
б) белковая часть фермента;
в) производное витамина;
г) находится в активном центре фермента;
д) участвует в превращении субстрата в продукт.
74. Кофермент пиридоксальфосфат участвует в реакциях:
а) карбоксилирования;
б) ацилирования;
в) трансаминирования;
г) окислительно-восстановительных;
д) декарбоксилирования.
75.Фермент ЛДГ:
а) холофермент;
б) относится к классу лиаз;
в) содержит в своем составе пиридоксальфосфат;
г) относится к классу оксидоредуктаз;
д) обладает абсолютной субстратной специфичностью.
76. Фермент, катализирующий реакцию на рис. 2.15:
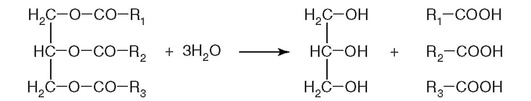
Рис. 2.15.
а) относится к классу лиаз;
б) относится к классу гидролаз;
в) относится к классу трансфераз;
г) использует кофермент NAD+;
д) обладает групповой субстратной специфичностью.
77. События, которые происходят в процессе ферментативного катализа E + S → ES → ES♠ → E + P:
а) установление индуцированного соответствия между субстратом и активным центром фермента;
б) образование ковалентных связей между субстратом и активным центром;
в) изменение конформации фермента;
г) образование фермент-субстратного комплекса;
д) дестабилизация связей в молекуле субстрата.
78. При образовании фермент-субстратного комплекса:
а) изменяется конформация субстрата;
б) образуются нековалентные связи между субстратом и ферментом;
в) изменяется пространственное расположение функциональных групп, участвующих в катализе;
г) изменяется порядок соединения аминокислот;
д) усиливается комплементарность между ферментом и субстратом.
79. При изменении pH среды в молекуле фермента происходит:
а) изменение степени ионизации групп фермента;
б) изменение конформации молекулы фермента;
в) разрушение пептидных связей;
г) изменение активности фермента;
д) изменение межрадикальных взаимодействий.
80. В состав активного центра дегидрогеназ могут входить коферменты:
а) биотин;
б) пиридоксальфосфат;
в) NAD+;
г) ТДФ;
д) FAD.
81. Фермент, катализирующий реакцию на рис. 2.16:

Рис. 2.16.
а) относится к классу трансфераз;
б) относится к классу оксидоредуктаз
в) простой фермент;
г) холофермент;
д) обладает абсолютной субстратной специфичностью.
82. Фермент, катализирующий реакцию на рис. 2.17:
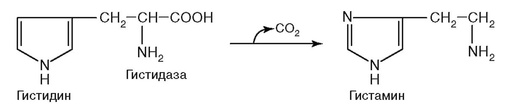
Рис. 2.17.
а) относится к классу лиаз;
б) относится к классу оксидоредуктаз;
в) простой фермент;
г) холофермент;
д) обладает абсолютной субстратной специфичностью.
83. Активность ферментов в присутствии ингибиторов снижается вследствие:
а) взаимодействия ингибитора с функциональными группами аминокислот активного центра;
б) взаимодействия ингибитора с функциональными группами аминокислот вне активного центра;
в) уменьшения количества фермент-субстратных комплексов;
г) нарушения нативной конформации фермента;
д) взаимодействия ингибитора с функциональными группами субстрата.
84. Ацетилсалициловую кислоту используют в качестве лекарственного препарата, так как она:
а) ингибитор ЦОГ;
б) вызывает ацетилирование ОН-группы серина ЦОГ;
в) взаимодействует с аллостерическим центром;
г) конкурентный ингибитор;
д) необратимый ингибитор.
85. Лекарственные вещества как ингибиторы ферментов являются:
а) обратимыми ингибиторами;
б) необратимыми ингибиторами;
в) аллостерическими регуляторами;
г) конкурентными ингибиторами;
д) неконкурентными ингибиторами.
86. Ингибиторы АХЭ, используемые для лечения миастений:
а) структурные аналоги ацетилхолина;
б) конкурентные ингибиторы;
в) неконкурентные ингибиторы;
г) обратимые ингибиторы;
д) необратимые ингибиторы.
87. Конкурентные ингибиторы ферментов изменяют:
а) Vmax реакции;
б) Km реакции;
в) Vmax и Km реакции;
г) специфичность к субстрату;
д) активность фермента.
88. Сульфаниламидные препараты:
а) снижают количество фолиевой кислоты в эукариотических клетках;
б) антиметаболиты;
в) структурные аналоги ПАБК;
г) влияют на метаболизм эукариотических клеток;
д) снижают количество фолиевой кислоты в бактериях.
89. Лекарственный препарат апротинин:
а) по химической структуре является пептидом;
б) используется для лечения острых панкреатитов;
в) увеличивает превращение трипсиногена в трипсин;
г) структурный аналог субстрата трипсина;
д) используется для лечения гнойных ран.
90. Ингибиторы фосфодиэстеразы применяются в качестве лекарственных средств:
а) при лечении астмы;
б) в качестве противовоспалительного средства;
в) при подагре;
г) как кардиотонические средства для терапии при острой сердечной недостаточности;
д) при панкреатитах.
91. Активность ферментов в клетке регулируется с участием следующих механизмов:
а) аллостерической регуляции;
б) частичного протеолиза;
в) фосфорилирования/дефосфорилирования;
г) необратимого ингибирования с помощью специфических ингибиторов;
д) белок-белкового взаимодействия.
92. Ферменты с аллостерической регуляцией, как правило:
а) мономерные белки;
б) олигомерные белки;
в) ингибируются необратимо;
г) имеют активные и аллостерические центры, расположенные в разных протомерах;
д) взаимодействуют с лигандом - эффектором в активном центре.
93. Регуляция ферментов с помощью частичного протеолиза включает:
а) изменение первичной структуры фермента;
б) изменение вторичной и третичной структуры фермента;
в) необратимую активацию;
г) необратимое ингибирование;
д) формирование активного центра.
94. Регуляция активности ферментов с помощью белок-белковых взаимодействий сопровождается:
а) необратимым ингибированием;
б) присоединением или отщеплением регуляторных белковых субъединиц;
в) присоединением или отщеплением белков-регуляторов;
г) изменением конформации фермента;
д) дефосфорилированием фермента.
95. Аллостерические ферменты:
а) катализируют скорость-лимитирующие реакции;
б) расположены в начале метаболического пути;
в) редко встречаются в клетке;
г) катализируют необратимые реакции;
д) катализируют реакции в месте разветвления метаболического пути.
96. Изменение активности ферментов по механизму фосфорилирования/ дефосфорилирования обеспечивают следующие ферменты:
а) сукцинатдегидрогеназа;
б) фосфопротеинфосфатаза;
в) глюкокиназа;
г) протеинкиназа;
д) аденилатциклаза.
97. Активация ферментов в клетке путем фосфорилирования:
а) зависит от концентрации ряда гормонов в крови;
б) происходит с участием АТФ;
в) сопровождается изменением аминокислотного состава ферментов;
г) происходит вслед за активацией протеинкиназ;
д) необратимый для клетки процесс.
98. Активация ферментов в клетке путем фосфорилирования:
а) ответ клетки на изменение концентрации ряда гормонов в крови;
б) сопровождается диссоциацией субъединиц фермента;
в) происходит с участием ATФ;
г) необратимый процесс ковалентной модификации фермента;
д) происходит после присоединения цАМФ к протеинкиназе А.
99. Регулировать активность ферментов можно:
а) с помощью аллостерического лиганда;
б) путем фосфорилирования/дефосфорилирования;
в) специфическим гидролизом пептидных связей;
г) с помощью ингибиторов;
д) с помощью токсинов.
100. Фермент протеинкиназа А:
а) олигомерный белок;
б) мономерный белок;
в) активируется цАМФ;
г) холофермент;
д) подвергается активации по механизму белок-белковых взаимодействий.
101. Фермент протеинкиназа А:
а) активируется цАМФ;
б) изменяет конформацию при действии на клетку кофеина и теофиллина;
в) может уменьшить активность при участии фосфодиэстеразы;
г) активная форма - олигомерный белок R2C2;
д) активная форма - каталитическая субъединица С.
102. Фермент КК:
а) мономерный белок;
б) олигомерный белок;
в) используется для диагностики инфаркта миокарда;
г) используется для диагностики гепатита;
д) относится к классу лиаз.
103. Фермент аспарагиназа:
а) уменьшает концентрацию аспарагина в крови;
б) увеличивает концентрацию аспарагина в крови;
в) уменьшает синтез белков во всех клетках организма;
г) уменьшает синтез белков в лейкозных клетках;
д) уменьшает концентрацию аспарагиновой кислоты в крови.
104. Фермент ЛДГ:
а) олигомерный белок;
б) используется для диагностики инфаркта миокарда;
в) используется для диагностики гепатита;
г) в разных тканях находится в форме изоферментов;
д) относится к классу оксидоредуктаз.
105. Использование ферментов в медицине возможно:
а) в качестве лекарственных препаратов;
б) для диагностики заболеваний;
в) для коррекции заболеваний, связанных с нарушениями функционирования ферментов;
г) для улучшения проведения нервного импульса;
д) в качестве аналитических реактивов.
106. Введение аспарагиназы в кровь больных лейкозом изменяет:
а) концентрацию аспарагина в крови;
б) синтез белков в лейкозных клетках;
в) синтез белков во всех клетках организма;
г) синтез аспарагина в лейкозных клетках;
д) концентрацию аспартата в крови.
107. Использование протеолитических ферментов в медицине возможно:
а) в лечении злокачественных заболеваний;
б) в аппаратах «искусственная почка» для разрушения мочевины;
в) для очистки ран;
г) для рассасывания рубцов;
д) в качестве заместительной терапии при нарушении пищеварения.
108. Определение активности ферментов в крови используется для:
а) диагностики наследственных энзимопатий;
б) постановки диагноза заболеваний;
в) контроля эффективности лечения ряда заболеваний;
г) диагностики воспалительных заболеваний органов дыхания;
д) диагностики воспалительных заболеваний печени.
109. Для энзимодиагностики инфаркта миокарда используют ферменты:
а) сукцинатдегидрогеназу;
б) ЛДГ;
в) гиалуронидазу;
г) KK;
д) аминотрансферазы.
110. Принципы энзимодиагностики основаны на:
а) выходе ферментов в кровь при повреждении тканей;
б) органоспецифичности;
в) высокой стабильности ферментов;
г) преобладании определенных изоферментов в разных тканях;
д) низкой активности или полном отсутствии активности ферментов в норме в крови.
111. Наследственые энзимопатии связаны с такими изменениями первичной структуры ферментов, при которых может произойти:
а) нарушение сродства активного центра к субстрату;
б) увеличение активности фермента;
в) изменение концентрации метаболитов в клетке;
г) увеличение количества фермента в клетке;
д) уменьшение активности фермента.
112. Нуклеазы как лекарства используются в медицине для:
а) инактивации ДHK-содержащих вирусов;
б) гибели бактерий;
в) лечения вирусных конъюнктивитов;
г) лечения вирусных гепатитов;
д) заместительной терапии при панкреатитах.
113. Виды специфичности:
1. Абсолютная субстратная специфичность.
2. Относительная субстратная специфичность.
3. Каталитическая специфичность. Фермент:
а) катализирует превращение субстрата по одному из путей превращения;
б) взаимодействует только с одним субстратом;
в) катализирует несколько разных превращений одного субстрата;
г) может взаимодействовать с группой подобных субстратов;
д) взаимодействует только с одним из стереоизомеров для данного вещества.
Ответ: 1 - б; 2 - г; 3 – а.
114. Установите соответствие между ферментом и его коферментом:
Кофермент:
1. Пиридоксальфосфат;
2. Кофермент A (HSKoA);
3. NAD.
Фермент:
а) ацилтрансфераза;
б) аминотрансфераза;
в) декарбоксилаза кетокислот;
г) дегидрогеназа;
д) карбоксилаза.
Ответ: 1 - б; 2 - а; 3 – г.
115. Установите соответствие между ферментом и его коферментом:
Кофермент:
1. ТДФ.
2. FAD.
3. Пиридоксальфосфат.
Фермент:
а) ацилтрансфераза;
б) декарбоксилаза аминокислот;
в) декарбоксилаза кетокислот;
г) дегидрогеназа;
д) карбоксилаза.
Ответ: 1 - в; 2 - г; 3 – б.
116. Установите соответствие между витамином и его коферментной формой:
Кофермент:
1. NAD.
2. FAD.
3. Кофермент А (HSKoA).
Витамин:
а) пантотеновая кислота;
б) В6;
в) никотинамид;
г) биотин;
д) В2.
Ответ: 1 - в; 2 - д; 3 – а.
117. Установите соответствие между ферментом и его коферментом:
Кофермент:
1. Пиридоксальфосфат.
2. ТДФ.
3. Биотин.
Фермент:
а) дегидрогеназа;
б) аминотрансфераза;
в) декарбоксилаза кетокислот;
г) ацилтрансфераза;
д) карбоксилаза.
Ответ: 1 - б; 2 - в; 3 – д.
118. Установите соответствие между коферментом и входящей в его состав активной группы (рис. 2.20.):
Активная группа:
1. рис. 2.18;
2. рис. 2.19;
3. рис. 2.20.
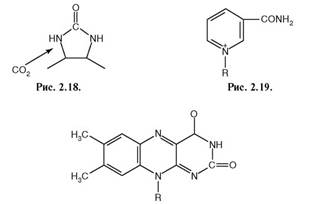 Рис. 2.20.
Рис. 2.20.
Кофермент:
а)В1
б)В2
в) РР;
г) биотин;
д) пантотеновая кислота.
Ответ: 1 - г; 2 - в; 3 – б.
119. Установите соответствие между классом фермента и его подклассом:
Класс фермента:
1. Оксидоредуктазы.
2. Лигазы.
3. Трансферазы.
Подкласс:
а) киназы;
б) дегидрогеназы;
в) гидроксилазы;
г) фосфатазы;
д) карбоксилазы.
Ответ: 1 - б; 2 - д; 3 – а.
120. Установите соответствие между параметром активности фермента и его единицей измерения:
Формула активности фермента:
1. 1 мкмоль превращенного субстрата /1 мин.
2. 1 моль превращенного субстрата /1 с.
3. Количество превращенного субстрата (мкмоль) / [время (мин) х количество белка (мг)].
Активность фермента:
а) катал;
б) единица активности (ME);
в) удельная активность;
г) число каталов;
д) число единиц активности.
Ответ: 1 - б; 2 - а; 3 – в.
121. Установите соответствие между катализируемой реакцией и ферментом:
Катализирует реакцию:
1. рис. 2.21;
2. рис. 2.22;
3. рис. 2.23.
а) оксидоредуктаза;
б) трансфераза;
в) изомераза;
г) гидролаза;
д) лигаза.

Рис. 2.21.
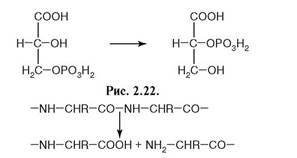
Рис. 2.23.
Ответ: 1 - г; 2 - в; 3 – г.
122. Установите соответствие между классом фермента и типом катализируемой реакции:
Катализирует реакцию:
1. Рис. 2.24;
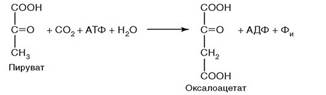
Рис. 2.24.
2. Глюкоза + АТФ + H2O → глюкозо-6-фосфат + АДФ.
3. Глюкоза-глюкоза (мальтоза) + H2O → 2 глюкоза.
Класс фермента:
а) оксидоредуктаза;
б) трансфераза;
в) изомераза;
г) гидролаза;
д) лигаза.
Ответ: 1 - д; 2 - б; 3 – г.
123. Установите соответствие между лекарственным веществом и свойством этого лекарственного вещества:
Лекарственное вещество:
1. Неостигмина метилсульфат (прозерин♠).
2. Теофиллин.
3. Ацетилсалициловая кислота.
Свойства лекарственного вещества:
а) структурный аналог ПАБК;
б) ингибитор фосфодиэстеразы;
в) ингибитор ксантиноксидазы;
г) структурный аналог ацетилхолина;
д) необратимый ингибитор.
Ответ: 1 - г; 2 - б; 3 – д.
124. Установите соответствие между механизмом ингибирования и свойством ингибитора:
Механизм ингибирования:
1. Конкурентный ингибитор.
2. Неконкурентный ингибитор.
3. Специфический необратимый ингибитор.
Свойства ингибитора:
а) структурный аналог субстрата;
б) взаимодействует с ОН-группами Сер активного центра;
в) структурный аналог продукта;
г) структурный аналог кофермента;
д) взаимодействует с ферментом в месте, отличном от активного центра.
Ответ: 1 - а; 2 - д; 3 – б.
125. Установите соответствие между лекарственным веществом и заболеванием, при котором оно применяется:
Лекарственное вещество:
1. Сульфаниламидные препараты.
2. Аллопуринол.
3. Апротинин.
Применение при заболевании:
а) инфаркт миокарда;
б) подагра;
в) инфекционные (микробные);
г) панкреатит;
д) гепатит.
Ответ: 1 - в; 2 - б; 3 – г.
126. Установите соответствие между лекарственным веществом и его свойством:
Лекарственное вещество:
1. Апротинин.
2. Сульфаниламидные препараты.
3. Ацетилсалициловая кислота.
Свойства лекарственного вещества:
а) механизм действия связан с ацетилированием ОН-группы серина активного центра фермента;
б) структурный аналог ПАБК;
в) структурный аналог ацетилхолина;
г) структурный аналог природного ингибитора трипсина;
д) структурный аналог гипоксантина.
Ответ: 1 - г; 2 - б; 3 – а.
127. Установите соответствие между метаболитом клетки и особенностями взаимодействия его с ферментом.
Метаболит клетки:
1. Субстрат.
2. Продукт.
3. Аллостерический эффектор.
Особенности взаимодействия с ферментом:
а) присоединяется к аллостерическому центру;
б) кофактор фермента;
в) высвобождается из активного центра;
г) претерпевает структурные изменения в ходе катализа;
д) вызывает диссоциацию фермента на субъединицы.
Ответ: 1 - г; 2 - в; 3 – а.
128. Установите соответствие между механизмом регуляции фермента и особенностями данного механизма регуляции:
Регуляция активности ферментов по механизму:
1. Аллостерическая регуляция.
2. Фосфорилирование/дефосфорилирование;
3. Белок-белковые взаимодействия.
Ответ: 1 - а; 2 - г; 3 – д.
Особенности регуляции:
а) взаимодействуют каталитический и регуляторный центры, локализованные в разных протомерах;
б) изменение первичной структуры фермента;
в) ингибирование необратимое;
г) вызвана активацией протеинкиназ и протеинфосфатаз;
д) сопровождается диссоциацией или ассоциацией белковых комплексов.
129. Установите соответствие между ферментом и заболеванием, при котором фермент используется в качестве диагностического маркера:
Фермент:
1. КК.
2. Амилаза.
3. Кислая фосфатаза.
Используется для диагностики заболеваний:
а) печени;
б) предстательной железы;
в) поджелудочной железы;
г) почек;
д) сердца.
Ответ: 1 - д; 2 - в; 3 – б.
130. Установите соответствие между ферментом и его применнеием:
Фермент:
1. Гиалуронидаза.
2. Нуклеаза.
3. Стрептокиназа.
Используется для:
а) рассасывания рубцов;
б) лечения гнойных ран;
в) лечения вирусных конъюнктивитов;
г) предотвращения тромбообразования;
д) лечения злокачественных образований.
Ответ: 1 - а; 2 - в; 3 – г.
131. Установите соответствие между ферментом и особенностями его регуляции:
Фермент:
1. Протеинкиназа.
2. Фосфопротеинфосфатаза.
3. Аденилатциклаза.
Ответ: 1 - б; 2 - в; 3 – г.
Особенности регуляции:
а) регулируется аллостерически;
б) катализирует фосфорилирование белков;
в) катализирует дефосфорилирование белков;
г) активируется в мембране после присоединения гормона к рецептору;
д) регулируется по механизму частичного протеолиза.
132. Установите соответствие между ферментом и его применением в качестве аналитического реактива:
Фермент:
1. Липаза.
2. Уреаза.
3. Глюкозооксидаза.
Используется в качестве аналитических реактивов для определения:
а) белка;
б) мочевины;
в) трацилглицерола;
г) глюкозы;
д) холестерола.
Ответ: 1 - в; 2 - б; 3 – г.
133. Установите соответствие между веществами в крови и ферментами, которые используются в качестве реактивов для определения этих веществ:
Вещества в крови:
1. Холестерол.
2. Глюкоза.
3. Мочевина.
Ферменты, используемые в качестве реактивов:
а) уреаза;
б) ксантиноксидаза;
в) холестеролоксидаза;
г) глюкокиназа;
д) глюкооксидаза.
Ответ: 1 - в; 2 - д; 3 – а.
 2020-09-24
2020-09-24 538
538








