Термодинамика — это наука об энергетических свойствах объектов, состоящих из очень большого числа частиц, в различных энергетических состояниях и их изменениях в результате процессов, в которых эти объекты участвуют. Термодинамику (от греч. therme — теплота, dinamis — сила) рассматривают как науку, изучающую взаимопревращения различных видов энергий.
Предмет химической термодинамики состоит в изучении превращений различных форм энергии при протекании химических реакций и способности химических систем выполнять полезную работу.
Фундаментальные положения химической термодинамики могут быть использованы для:
• предсказания принципиальной возможности протекания химически реакции;
• предсказания направления самопроизвольного протекания процесса до достижения равновесного состояния;
• определения количества энергии, теоретически необходимого для проведения реакции, или количества энергии, выделяющегося при ее самопроизвольном протекании.
Основным объектом изучения термодинамики является термодинамическая система.
Термодинамическая система — любая достаточно большая совокупность объектов, отделенная от окружающей среды реальной или воображаемой граничной поверхностью.
В соответствии с данным определением к термодинамической системе можно отнести живую клетку, химический реактор (рис. 2.1), человека и т.п.
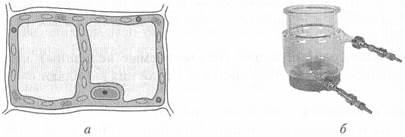
Рис. 2.1. Примеры термодинамической системы:
живая клетка (а), химический реактор ( б )
Окружение или окружающая среда — это часть материального мира за пределами условно выделенной из него термодинамической системы. Окружение включает все остальные объекты, которые могут оказывать влияние на исследуемую систему.
По характеру взаимодействия с внешней средой различают изолированные, закрытые и открытые термодинамические системы (рис. 2.2).
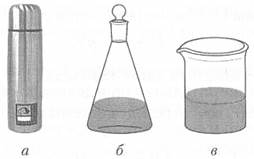
Рис. 2.2. Примеры термодинамических систем:
изолированной (а), закрытой (б) и открытой (в)
Изолированная система — система, не обменивающаяся с окружающей средой ни энергией (теплотой или работой), ни веществом. Несмотря на невозможность ее практического воплощения, понятие изолированной системы позволяет сформулировать основные законы термодинамики.
Закрытая система — система, способная обмениваться с окружающей средой энергией, но не веществом.
Открытая система — система, способная обмениваться с окружающей средой и энергией, и веществом.
Система может состоять из одной фазы (гомогенная система) или нескольких фаз (гетерогенная система).
Фазой называется совокупность однородных по составу и физико-химическим свойствам частей системы, отделенных от других частей системы поверхностью раздела. Важно отметить, что свойства системы при переходе через поверхность раздела фаз изменяются скачкообразно.
Состояние системы определяется совокупностью физико-химических свойств (термодинамических параметров и термодинамических функций), которыми она характеризуется в данный момент времени.
Термодинамические параметры (измеряемые величины) подразделяют на
· экстенсивные, которые прямо пропорциональны количеству вещества системы, т.е. складываются при объединении систем (масса, объем, площадь поверхности и т.п.),
· и интенсивные, которые не зависят от количества вещества системы и выравниваются при объединении систем (давление, температура, концентрация).
Термодинамические функции (неизмеряемые величины) зависят от термодинамических параметров системы. Среди них выделяют следующие функции.
Функции состояния, зависящие только от состояния, в котором находится система, и не зависящие от пути, по которому система пришла к данному состоянию (например, внутренняя энергия и энтальпия).
Функции перехода, зависящие от пути, по которому система перешла из одного состояния в другое (например, теплота и работа).
Внутренняя энергия системы (U, Дж) определяется всеми видами движений и взаимодействий, составляющих систему элементарных частиц, молекул, атомов и ионов, а именно: энергией поступательного, колебательной и вращательного движений, энергией электромагнитного, гравитационной и других силовых взаимодействий.
Во внутреннюю энергию не включаются кинетическая и потенциальная энергии, характеризующие всю систем как единое целое (перемещение всей системы в окружающей среде и взаимодействие с внешними силовыми полями).
Абсолютное значение внутренней энергии определить невозможно, так как нам неизвестны все возможные виды взаимодействий внутри системы. Однако можно определит ее изменение (∆U) при переходе системы из начального состояния (1) в конечное (2):
∆U = U2-Uv
Энтальпия системы (Н, Дж) определяется соотношением
Н = U + pV,
где U — внутренняя энергия; р — давление; V — объем системы.
Абсолютное значение энтальпии определить также невозможно; определяют ее изменение (∆Н) при переходе системы из начального состояния (1) в конечное (2):
∆Н = Н 2 – Н1.
 2020-09-24
2020-09-24 154
154








