Внутренняя энергия системы (U) в результате какого-либо процесса (в том числе и химического) может изменяться на величину ∆U. Передача энергии системе или от нее может происходить в форме теплоты Q и (или) работы А. Эти величины связаны между собой следующим уравнением:
Q = ∆ U + А,
где Q — теплота, поглощенная системой; ∆U — изменение внутренней энергии системы; А — работа, совершаемая системой.
Это математическое выражение носит название первого закона термодинамики:
Поглощенная системой теплота расходуется на изменение внутренней энергии системы и на совершение ею работы против внешних сил.
По сути, первый закон термодинамики является не чем иным, как одной из формулировок закона сохранения энергии, в соответствии с которым энергия, потерянная системой, равна энергии, приобретенной внешней средой, или энергия, приобретенная системой, равна энергии, потерянной внешней средой. Энергия не может быть создана или уничтожена, а может лишь переходить из одной формы в другую (Р. Майер, 1842; Д. Джоуль, 1842; Г. Гельмгольц, 1847).
Если работа связана только с изменением объема системы при постоянном давлении, подстановка уравнения приводит к соотношению
∆ U = Q – p ∆ V.
В изохорных процессах (реакции, проходящие без изменения объема системы ∆V = 0) теплота, подведенная к системе, расходуется только на увеличение ее внутренней энергии:
∆U=QV,
где QV — теплота, поглощаемая при постоянном объеме.
Чаще всего химические реакции проводят в открытых сосудах, например: в пробирках, химических стаканах, химических реакторах, сообщающихся с окружающей средой. В этом случае давление в системе остается постоянным и совпадает с атмосферным — это так называемые изобарные процессы (реакции, проходящие при постоянном давлении):
Qp = ∆U – А
где Qр — теплота процесса при неизменном давлении
Подставив, получим,
Qp = ∆U + p∆V.
Изменение энтальпии в процессе при постоянном давлении равно
∆Н = ∆U + p∆V.
Сравнивая эти уравнения, получим
∆Н = Qp
Таким образом, теплота, подведенная к системе в условиях изобарного процесса, расходуется только на увеличение ее энтальпии.
Термохимия.
Раздел химии, занимающийся изучением тепловых эффектов, наблюдаемых при протекании химических реакций, называется термохимией.
Тепловой эффект — количество теплоты, выделяющееся или поглощающееся при протекании физико-химического процесса, если:
а) процесс протекает при р = const или V = const;
б) в системе совершается только работа расширения;
в) температура исходных веществ и продуктов реакции одинакова.
Экзотермическим называют процесс, сопровождающийся выделением теплоты, эндотермическим — процесс, сопровождающийся поглощением теплоты.
Если процесс протекает при постоянном давлении, то тепловой эффект представляет собой изменение энтальпии системы:
∆Н = ∆Н прод - ∆Н реаг.
Если ∆Н < 0 — это экзотермический процесс, ∆Н > 0 — эндотермический процесс (рис. 4.3).
Если процесс не сопровождается изменением объема, тепловой эффект процесса равен изменению внутренней энергии системы ∆U. Если ∆U < 0 - экзотермический процесс, ∆U > 0 — эндотермический процесс.
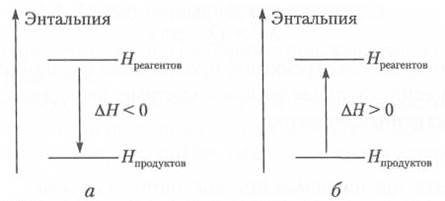
Рис. 2.3. Экзотермическая ( а ) и эндотермическая (б) реакции
Термохимические уравнения реакции — уравнения реакции, в которых помимо формул исходных веществ и продуктов (с соответствующими стехиометрическими коэффициентами) указаны их агрегатные состояния и отвечающий этой реакции тепловой эффект (изменение энтальпии), на пример:
0,5N2(г.) + 1,5Н2(г.) = NH3(г.) + 46,2 кДж
(термохимическая форма записи)
или
0,5N2(г.) + 1,5Н2(г.) = NH3(г.); ∆Н = -46,2 кДж/моль.
(термодинамическая форма записи)
Рассмотрим стандартные изменения энтальпии.
Изменения энтальпии в ходе химической реакции зависят от температуры, давления и физического состояния веществ, участвующих в процессе. Величина ∆Н зависит также от количества этих веществ. Поэтому изменение энтальпии может быть характеристической величиной лишь в случае, если ее измерение проводится при определенных условиях, называемых стандартными.
Стандартные условия:
· все вещества являются химически чистыми и соответствуют приводимой химической формуле;
· твердые и жидкие вещества находятся в устойчивых для данных условий агрегатных состояниях и аллотропных модификациях;
· количества веществ равны 1 моль или вещества в растворе содержатся в количествах 1моль на 1000 г растворителя;
· давление постоянно и равно 101,3 кПа, или 1 атм (ИЮПАК рекомендует использовать точное значение 100 кПа);
· температура постоянна и может иметь любое значение, но обычно выбирается равной 25°С (298 К).
На практике, особенно применительно к разбавленным водным растворам, каковыми являются физиологические жидкости, используют молярные концентрации. В этом случае стандартное состояние соответствует концентрациям растворенных веществ 1 моль/л.
Стандартная энтальпия образования (∆fH0298) — это тепловой эффект реакции образования 1 моль какого-либо вещества из простых веществ в стандартных условиях при 298К.
Стандартная энтальпия образования простого вещества в наиболее устойчивой аллотропной модификации равна нулю.
Стандартная энтальпия образования аммиака соответствует тепловому эффекту реакции
1,5Н2(г) + 0,5N2(г) = NH3(г) + 45,94 кДж
при постоянном давлении (298 К) ∆fH0298 = -45,94 кДж/моль.
Энтальпии образования твердых соединений, как правило, имеют большие (по абсолютной величине) отрицательные значения, по сравнению с энтальпиями образования газов.
Стандартная энтальпия сгорания (∆сH0298) — это тепловой эффект реакции сгорания в избытке кислорода 1 моль вещества в его стандартном состоянии при температуре 298 К и давлении 101,3 кПа (1 атм).
Стандартная энтальпия сгорания этилового спирта соответствует тепловому эффекту реакции
С2Н5ОН(ж) + 3,5О2(г) = 2СО2(г) + 3Н2О(ж) + 1638 кДж
при постоянном давлении (298 К) ∆сH0298 = -1638 кДж/моль.
Стандартные энтальпии образования и стандартные энтальпии сгорания различных веществ сведены в соответствующие таблицы, которые имеются в справочной литературе.
Стандартная энтальпия реакции (∆rH0298) это изменение энтальпии при 298К в стандартных условиях в расчете на количества веществ, соответствующие стехиометрическим коэффициентам.
Калориметрия — совокупность экспериментальных методов измерения тепловых эффектов, сопровождающих различные физико-химические и биологические процессы.
Калориметр — изолированный сосуд для измерения количества теплоты, высвобождаемой или поглощаемой в результате химической реакции или фазового превращения (рис. 2.4).
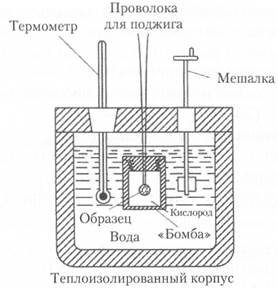
Рис. 2.4. Схема калориметра
Суть эксперимента состоит в измерении изменения температуры реакционной смеси в результате химического или иного превращения. В некоторых случаях изменение температуры определяется в охлаждающей реакционный сосуд жидкости, например воде. Калориметр представляет собой прочный закрывающийся сосуд, окруженный теплоизолирующей водяной рубашкой. Образец известной массы помещается внутри бомбы в атмосфере чистого кислорода под давлением 25 атм. Затем образец поджигают с помощью электрической искры. За счет выделяющейся при горении энергии происходит нагрев водяной рубашки. Поскольку сгорание вещества в калориметрической бомбе происходит при постоянном объеме, выделяющая тепловая энергия численно равна изменению внутренней энергии U.
Выделяемая в ходе эксперимента энергия может быть рассчитана и следующему уравнению:
Q = (С сосуд + m ∙ C содерж) ∆T
где Q — энергия, передаваемая в форме тепла сосуду и его содержимом; С сосуд — теплоемкость сосуда; т — масса содержимого сосуда (вода или реакционная смесь); С содерж — удельная теплоемкость содержимого; ∆T — измеренное изменение температуры содержимого сосуда.
Энтальпии реакций, которые невозможно провести в лабораторных условиях, могут быть вычислены по известным энтальпиям других реакций.
Основной закон термохимии — закон Гесса (закон постоянства сумм теплот реакции):
тепловой эффект реакции не зависит от пути проведения процесса, а определяется только начальным и конечным состоянием системы.
Таким образом, если какую-либо реакцию теоретически представить в виде определенного числа последовательных стадий, то изменение энтальпии реакции будет равно сумме изменений энтальпий на каждой стадии (рис. 2.5)
∆НА = ∆НВ = ∆HBl + ∆НВ2.
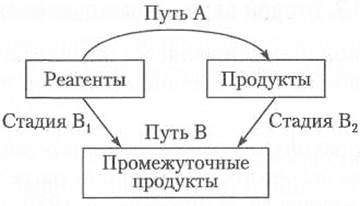
Рис. 2.5. Стадии реакции
Несмотря на то, что закон Гесса был установлен опытным путем, он непосредственно вытекает из свойств функций состояния системы: внутренняя энергия U и энтальпия H являются функциями состояния системы, следовательно, их изменение ∆U и ∆Н не зависит от пути процесса, а равно разности ∆U = U2 – U1; ∆Н = H2 – H1 между значениями U2 и Н2 в конечном состоянии и значениями U1 и Н1 в начальном состоянии системы.
Следствия из закона Гесса.
1. Тепловой эффект химической реакции (∆rH0) равен разности между суммой теплот образования продуктов реакции (∑∆ fH 0прод) и суммой теплот образования исходных веществ (∑∆ fH 0 реаг) с учетом их стехиометрических коэффициентов. Для теплового эффекта реакции, проводимой при постоянном давлении
∆rH0 = ∑ νj ∆ fH0прод - ∑ νi ∆ fH0реаг.
Пример 2.1. Рассчитаем тепловой эффект реакции образования мочевины (одного из важнейших продуктов жизнедеятельности организма) из аммиака и диоксида углерода:
2NH3(r) + СО2(г) = CO(NH3)2(k) + Н2О(ж)
∑∆ fH 0 -45,94 -393,51 -333,1 -241,83
∆rH0 = (-333,1 – 241,83) - (-45,94∙2 – 393,51) = -88,54 кДж.
2. Тепловой эффект химической реакции (∆rH0) равен разности между суммой теплот сгорания исходных веществ (∑∆CH0реаг) и суммой теплот сгорания продуктов реакции (∑∆CH0прод) с учетом их стехиометрических коэффициентов:
∆rH0 = ∑ νj ∆ CH0реаг - ∑ νi ∆ CH0прод.
Пример 2.2. Рассчитаем тепловой эффект реакции молочнокислого брожения глюкозы, зная, что стандартные теплоты сгорания глюкозы и молочной кислоты равны -2810 и -1344 кДж/моль соответственно:
С6Н12O6 → 2СН3СН(ОН)СООН
∑∆ CH 0 -2811 -1344
∆rH0 = -2811 - (-1344∙2) = -123 кДж.
3. Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа).
 2020-09-24
2020-09-24 176
176








