Зависимость скорости реакции от концентрации выражается законом действующих масс (Н. Н. Бекетов - 1865 г., Гульдберг и Вааге - 1867 г.): при постоянной температуре скорость простой химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Например, для простой реакции
2NO(г) + О2(г) ® 2NO2(г)
закон действующих масс может быть выражен формулой:
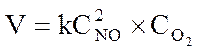
где V - скорость химической реакции, k - константа скорости, СNO и СО2 - концентрации реагирующих веществ.
Реакция в гетерогенной системе протекает на поверхности раздела между фазами. Закон действующих масс не учитывает концентрации твердых веществ, т. к. они реагируют лишь на поверхности, которая остается неизменной, (их «концентрации» постоянны). Так для реакции
С(к) + O2(г) ® СО2(г)
уравнение закона действующих масс имеет вид: V = k•СО2
Смысл константы скорости становится ясным, если принять концентрации реагирующих веществ, равными 1 моль/л. Тогда V = k, т.е. константа скорости - это скорость реакции при концентрациях реагирующих веществ, равных единице. Если реакция сложная, то ее скорость определяется той стадией, которая идет наиболее медленно, поэтому уравнение закона действующих масс составляется на основе уравнения реакции этой стадии. Например, реакции разложения пероксида водорода соответствует уравнение:
|
|
|
2Н2O2 ® 2Н2О + O2
Однако, экспериментально найденной зависимости скорости от концентрации соответствует концентрация пероксида водорода не во второй, а в первой степени, т. е.
V = k•С(Н2О2)
Это свидетельствует о том, что данная реакция является сложной и протекает в две стадии:
I. Н2O2 ® Н2O + О
II. O + O ® O2
Причем стадия (I) протекает медленно и определяет скорость всего процесса.
 2020-09-24
2020-09-24 126
126








