Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа (1884 г.): при повышении температуры на каждые десять градусов скорость большинства реакций увеличивается в 2-4 раза. Правило Вант-Гоффа математически описывается формулой:
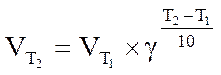
где V(T2) и V(T1) – скорость реакций при температуре Т2 и Т1; g - температурный коэффициент реакции, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10о.
Например, при повышении температуры на 30°, скорость реакции повысится в 8 раз, если температурный коэффициент равен двум:
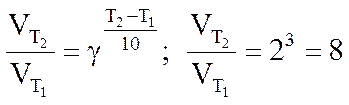
Причину такого влияния выявил С.Аррениус, он установил, что не все соударения частиц заканчиваются взаимодействием, реагировать при столкновении могут только активные частицы.
Активными являются частицы, имеющие избыточную энергию. Этот избыток энергии Аррениус назвал ЭНЕРГИЕЙ АКТИВАЦИИ. Значение энергии активации для большинства реакции лежит в пределах от 0 до 500 кДж/моль.
Обычно химический процесс идет через стадию образования активного (активированного) комплекса – группы активных частиц, находящихся в состоянии перераспределения химических связей между атомами реагентов. Образование активного комплекса не требует немедленного перераспределения химических связей, поэтому энергия активации может быть меньше.
|
|
|
В зависимости от природы реагирующих веществ и условий их взаимодействия в элементарных актах реакции могут принимать участие атомы, молекулы, ионы или радикалы. В соответствии с этим различают молекулярные реакции, ионные и радикальные. Тип частиц можно определить по величине энергии активации. Наибольшая энергия активации (105-450 кДж/моль) характерна для молекулярных реакций, меньшая – для ионных (0-80 кДж/моль) и радикальных (0-40 кДж/моль) реакций. Например,
для реакции:
Сl2 + Н• ® НСl + Cl• энергия активации равна 8 кДж/моль,
для реакции
Н2 + Cl• ® НСl + Н• - 24 кДж/моль.
Чем выше температура системы, тем больше активных частиц она содержит, чем выше концентрация частиц, тем чаще происходят столкновения частиц. Поэтому скорость реакции будет тем больше, чем выше температура и концентрация взаимодействующих веществ.
 2020-09-24
2020-09-24 237
237








