В химической кинетике реакции делятся на простые и сложные.
Реакции, состоящие только из одного элементарного акта, называются простыми. Например, к простым реакциям относятся:
1) N2O5 ® NO2 + NO + О2
2) 2HI ® Н2 + I2
3) 2NO + Сl2 ® 2NOCl
Число частиц, участвующих в элементарном акте реакции, определяет ее молекулярность. Так, реакция (1) называется мономолекулярной, реакция (2) - биомолекулярной, реакция (3) - триомолекулярной.
В большинстве случаев реакции протекают в несколько стадий. Такие реакции называют сложными. Сложные реакции подразделяются на последовательные, параллельные, сопряженные и др:
Последовательные реакции – это реакции, в которых продукты предыдущих стадий расходуются в последующих:
НIО3 + 3H2SO3 ® НI+ 3H2SO4;
5НI + HIO3 ® 3I2 + 3H2O;
I2 + H2O ® НI + HIO
Параллельные реакции протекают одновременно в нескольких направлениях из одних и тех же исходных веществ:
HClO ® HCl + O
3HClO ® 2HCl + HClO3
2HClО ® Cl2O + H2O
Две реакции называют сопряженными, если одна из них возбуждает протекание другой:
I. a) 6HI + 2Н2СгО4 ® Сг2О3 + 3I2 + 5Н2O
б) 6FeO + 2Н2СгO4 ® 3Fe2O3 + Сг2O3 + 2Н2O
II. а)10НСl + 2KМnO4 + 3H2SO4 ® 5Сl2 + 2MnSO4 + K2SO4 + 8H2O
б)10FeSO4 + 2KMnO4 +8H2SO4 ® 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
III. a) HBrO3 + 3H3AsO3 ® HBr + 3H3AsO4
б) HBrO3 + 3H2SO3 ® HBr + 3H2SO4
IV. a) 2HI + Н2О2 ® I2 + 2Н2O
б) 2FeSO4 + Н2О2 ® 2FeOHSO4
Реакция (а) протекает только при наличии реакции (б).
Участник обеих реакций называется АКТОРОМ (Н2СrO4, КМnO4, НВrO3, Н2О2— акторы).
С актором непосредственно реагирует ИНДУКТОР (FeO, FeSO4, H2SO3, FeSO4 — индукторы). АКЦЕПТОР реагирует с актором в присутствии индуктора (HI, HCl, H3AsO3, HI — акцепторы).
Особо выделяют цепные – свободнорадикальные реакции, в которых можно встретить комбинацию трех указанных выше типов реакций. Примером цепной реакции служит реакция между хлором и водородом:
Н2 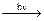 2H•; Сl2
2H•; Сl2 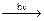 2Cl•;
2Cl•;
Н• + Сl2 ® НСl + Сl• Сl• + Н2 ® НСl + Н•
и т. д. до обрыва цепи.
Для простых реакций показатели степени в уравнении закона действующих масс совпадают с коэффициентами в уравнении реакций.
Например:
N2O5 ® NO2 + NO + O2; V = k • С(N2О5)
2HI ® H2 +I2 V = k • С2(HI)
2NO + Cl2 ® 2NOCl; V = k • С2(NО) • С(Cl2)
Эти показатели характеризуют порядок реакции. Обычно они определяются экспериментально.
Если скорость реакции прямо пропорциональна первой степени концентрации, например, V = k • С(N2О5), то реакцию называют реакцией первого порядка; если второй степени, например V = k • С2(HI), то это реакция второго порядка.
Реакция 2NO + Cl2 ® 2NOCl; V = k • С2(NО) • С(Cl2) - реакция третьего порядка.
Для сложных реакций порядок реакции указывает на молекулярность стадии лимитирующей скорость всего процесса.
 2020-09-24
2020-09-24 116
116








