Скорость и механизм химических реакций изучает раздел химии, называемой химической кинетикой. Механизм реакции это совокупность стадий, из которых состоит реакция. Механизмы химических реакций изучает молекулярная кинетика. С позиции молекулярной кинетики скорость реакции – это число элементарных актов взаимодействия, происходящих в единицу времени в единице объема для гомогенных систем или на единице площади поверхности раздела фаз - для гетерогенных при постоянной температуре и постоянном объеме системы.
Элементарным актом реакции называют соударение активных частиц (молекул, ионов, радикалов), завершающееся превращением одних частиц в другие.
Математическую зависимость скорости реакции от концентрации реагирующих веществ изучает формальная кинетика. Согласно формальной кинетике, скорость реакции равна отношению изменения концентрации исходных веществ или продуктов реакции к отрезку времени, за который оно произошло:
V=± 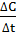
где V - скорость химической реакции, ∆t- отрезок времени, ∆C – изменение концентрации реагирующих веществ или продуктов реакции.
Стремление химических реакций достигать равновесия - основные свойства химических реакций.
Скорость химической реакции зависит от природы реагирующих веществ, температуры, концентрации реагирующий веществ (для газов от давления), от присутствия катализатора.
 2020-09-24
2020-09-24 137
137








