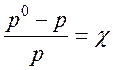
где р — давление пара над раствором, Па; р0 — давление пара над чистым растворителем, Па; χ — молярная доля растворителя равная
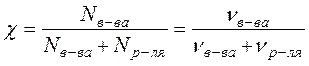 .
.
Закон Рауля соблюдается для разбавленных реальных растворов: чем разбавленнее раствор, тем более он приближается к идеальному.
Понижение температуры замерзания и повышение температуры кипения растворов. Прямыми следствиями понижения давления пара над раствором являются изменения температуры замерзания и кипения растворов по сравнению со значениями этих величин для чистого растворителя.
Эффекты повышения температуры кипения и понижения температуры замерзания растворов могут качественно быть объяснены с помощью принципа Ле Шателье.
Если в равновесную систему жидкость — пар ввести растворимое нелетучее вещество, то давление пара растворителя над раствором уменьшится, так как часть растворителя будет удерживаться в сольватной оболочке около частиц растворенного вещества. Чтобы компенсировать понижение давления пара и достигнуть прежнего равновесного состояния, раствор нужно нагреть до более высокой температуры.
Если растворить в жидкой фазе некоторое количество нелетучего вещества, то концентрация молекул воды в жидкой фазе уменьшится. В соответствии с принципом Ле Шателье начнет идти процесс, увеличивающий количество воды в жидкой фазе, — плавление льда. Для установления, нового равновесия раствор необходимо охладить, т.е. понизить температуру.
Изучая замерзание и кипение растворов, Рауль установил:
Эбуллиоскопический закон:
повышение температуры кипения Δtºкип разбавленных растворов неэлектролитов прямо пропорционально моляльной концентрации раствора:
Δtºкип = Е·Cm
Криоскопический закон:
понижение температуры замерзания Δtºкр разбавленных растворов неэлектролитов прямо пропорционально моляльной концентрации раствора:
Δtºкр = К·Cm
где Cm — моляльная концентрация, моль/кг; Е и К — коэффициенты пропорциональности, кг·К·моль-1, которые называются соответственно эбуллиоскопической и криоскопической константами.
Физический смысл констант Е и К становится ясен, если принять Cm = 1. Тогда Δtºкип = Е, а Δtºкр = К.
Эбуллиоскопические и криоскопические константы зависят только от природы растворителя и не зависят от природы растворенного вещества.
Измерение температур кипения и замерзания растворов лежит в основе эбуллиометрического и криометрического методов определения молярных масс веществ (эбуллиометрия и криометрия).
Осмос.
В животных и растительных организмах, а также в экспериментальных исследованиях существуют и применяются полупроницаемые перегородки — мембраны, разделяющие растворитель и раствор или растворы различной концентрации. Мембраны различают по составу, структуре, размеру пор, отношению к различным растворителям. Они могут быть животного (например, мочевой пузырь), растительного (оболочка клетки) и искусственного происхождения (пленки из целлофана, коллодия). Некоторые из них проницаемы только для растворенного вещества, другие — только для молекул растворителя. Например, глиняная мембрана, проницаема только для молекул воды. При наличии мембран в растворах наблюдают явление осмоса.
Осмосом называют преимущественно одностороннее проникновение молекул растворителя (диффузию) через полупроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией.
Необходимым условием возникновения осмоса является наличие растворителя и раствора или двух растворов различной концентрации, разделенных полупроницаемой мембраной.
Например, вода и водный раствор глюкозы разделены мембраной, проницаемой только для молекул воды. Тогда будет наблюдаться переход воды в раствор и через некоторое время мембрана вздувается. Вода диффундирует через мембрану в обоих направлениях. Но в раствор переходит больше молекул воды, чем в обратном направлении, так как концентрация воды в растворе меньше.
Аналогично протекает процесс, если полупроницаемой мембраной разделены два водных раствора глюкозы различной концентрации. В этом случае наблюдается переход воды из менее концентрированного раствора в более концентрированный.
Движущей силой осмоса является стремление системы к выравниванию концентраций. Осмос — это самопроизвольный процесс.
Осмотическое давление. Наполним сосуд с полупроницаемыми стенками водным раствором глюкозы (1) и поместим в сосуд с водой (2) так, чтобы уровни жидкостей в сосудах совпадали. В результате осмоса объем раствора в сосуде (1) увеличивается, а уровень воды в сосуде (2) постепенно повышается.
При этом создается препятствующее осмосу дополнительное гидростатическое давление столба жидкости. При некоторой высоте гидростатическое давление достигает такого значения, при котором осмос прекратится, т.е. наступит осмотическое равновесие. Гидростатическое давление столба жидкости при осмотическом равновесии определяет осмотическое давление раствора.
Чтобы прекратить осмос, необходимо приложить к раствору внешнюю силу. Осмотическим давлением называют величину, измеряемую минимальным гидравлическим давлением, которое нужно приложить к раствору, чтобы осмос прекратился.
Законы осмотического давления. Вант-Гофф предложил эмпирическое уравнение для расчета осмотического давления разбавленных растворов неэлектролитов:
росм = R·T·Cм
где росм — осмотическое давление, кПа; Cм — молярная концентрация, моль/л; R — универсальная газовая постоянная, Т — абсолютная температура, К.
Это выражение аналогично уравнению Клапейрона — Менделеева для идеальных газов, однако эти уравнения описывают разные процессы.
Коллигативные свойства разбавленных растворов неэлектролитов количественно взаимосвязаны. Поэтому, определив одно из них, можно вычислить другие.
Роль осмоса и осмотического давления в биологических системах. Явление осмоса играет важную роль во многих химических и биологических системах. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Упругость клеток (тургор), обеспечивающая эластичность тканей и сохранение определенной формы органов, обусловлена осмотическим давлением. Животные и растительные клетки имеют оболочки или поверхностный слой протоплазмы, обладающие свойствами полупроницаемых мембран. При помещении этих клеток в растворы с различной концентрацией наблюдается осмос.
 2020-09-24
2020-09-24 638
638








