В процессе образования раствора энтальпия системы может как увеличиваться, так и уменьшаться. Изменение энтальпии процесса растворения нужно рассматривать в соответствии с законом Гесса как алгебраическую сумму эндо- и экзотермических вкладов всех процессов, сопровождающих процесс растворения.
1. эндотермические эффекты разрушения кристаллической решетки веществ, разрыва связи молекул, разрушения исходной структуры растворителя
2. экзотермические эффекты образования различных продуктов взаимодействия, в том числе сольватов.
При растворении газов энтальпия ΔНкр = 0, так как не нужно затрачивать энергию на разрушение кристаллической решетки. Поэтому процесс растворения газов почти всегда процесс экзотермический.
При растворении твердых веществ с молекулярной кристаллической структурой и жидкостей молекулярные связи не очень прочные. Это приводит к тому, что растворение, например, спиртов и сахаров представляет собой экзотермический процесс.
При растворении твердых веществ с ионной решеткой соотношения энергий Екр и Есольв могут быть различными. Однако в большинстве случаев энергия, выделяемая при сольватации ионов, не компенсирует энергию, затрачиваемую на разрушение кристаллической решетки, а, следовательно, и процесс растворения является эндотермическим.
Растворимость.
Если растворимое вещество контактирует с растворителем, процесс образования раствора во многих случаях идет самопроизвольно до тех пор, пока не достигается некоторая предельная концентрация (наступает насыщение).
Раствор, содержащий при данной температуре максимальное количество растворенного вещества и находящийся в равновесии с избытком растворяемого вещества, называют насыщенным.
Пересыщенный раствор — раствор, концентрация которого выше, чем в насыщенном.
Раствор с меньшей концентрацией, чем насыщенный, называют ненасыщенным.
Способность вещества растворяться в том или ином растворителе называют растворимостью. Численно растворимость вещества равна концентрации его насыщенного раствора.
Растворимость выражают через массу растворенного вещества (в граммах), насыщающего 100 г растворителя. Соответствующую величину называют коэффициентом растворимости.
Растворимость зависит:
а) от природы растворяемого вещества и растворителя,
б) температуры,
в) давления,
г) присутствия в растворе других веществ.
Способность веществ растворяться определяется характером сил взаимодействия между молекулами компонентов раствора: растворитель — растворитель, растворенное вещество — растворенное вещество, растворитель — растворенное вещество.
Из практики известно, что наибольшая взаимная растворимость достигается, когда эти силы имеют подобный характер, т. е. «подобное растворяется в подобном».
Жиры хорошо растворимы в неполярных жидкостях: эфире, гексане, бензоле. В высокополярном растворителе — воде — бензол, эфир, жиры практически нерастворимы.
Вещества с ионным типом связи и вещества, состоящие из полярных молекул, лучше растворяются в полярных растворителях, таких, как вода, спирты. Эти растворители характеризуются высокой диэлектрической проницаемостью.
Высокая растворимость веществ довольно часто обусловлена образованием межмолекулярных, в частности водородных, связей. Например, неограниченная взаимная растворимость воды и спирта объясняется образованием водородных связей между молекулами воды и спирта.
Влияние внешних условий на растворимость — давления, температуры — можно качественно оценить, воспользовавшись принципом Ле Шателье. Подобные оценки необходимы в практике глубоководных погружений, при работе в горячих цехах и т. п.
При растворении твердых и жидких веществ в воде объем системы обычно изменяется незначительно, поэтому давление практически не влияет на растворимость таких веществ. Только при очень высоких давлениях это влияние становится заметным.
Зависимость растворимости твердых веществ от температуры определяется знаком и числовым значением теплоты растворения.
Биологическая роль растворимости веществ прежде всего связана со способностью их проходить через биологические мембраны. При транспорте чужеродных для живых организмов соединений — лекарственных препаратов и их метаболитов с помощью простой диффузии только жирорастворимые неионизированные молекулы легко проходят через мембраны (рис. 4.4.).
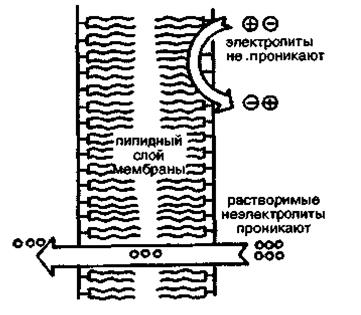
Рис. 4.4. Проницаемость липидного слоя клеточных мембран для гидрофобных молекул и непроницаемость для гидрофильных ионов электролитов.
Неэлектролиты транспортируются в соответствии с их растворимостью в липидах (относятся к главным компонентам мембран), а электролиты — в соответствии со степенью их диссоциации и растворимостью в липидах недиссоциированных молекул.
 2020-09-24
2020-09-24 1624
1624
