Природа процесса растворения сложна. Естественно возникает вопрос, почему некоторые вещества легко растворяются в одних растворителях и плохо растворимы или практически нерастворимы в других.
Образование растворов связано с физическим процессом – диффузией растворенного вещества и растворителя. Благодаря диффузии частицы — молекулы, ионы — удаляются с поверхности растворяющегося вещества и равномерно распределяются по всему объему растворителя. Именно поэтому в отсутствие перемешивания скорость растворения зависит от скорости диффузии. Но не только физическими процессами объясняется неодинаковая растворимость веществ в различных растворителях.
Важную роль при растворении играют химические процессы. Д.И. Менделеев доказал существование гидратов серной кислоты Н2SО4·Н2О, Н2SО4·2Н2О, Н2SО4·4Н2О и некоторых других веществ, например С2Н5ОН·3H2О. В этих случаях растворение сопровождается образованием химических связей частиц растворяемого вещества и растворителя. Этот процесс называется сольватацией; в частном случае, когда растворителем является вода, — гидратацией.
Химические взаимодействия осуществляются за счет донорно-акцепторных связей — здесь ионы растворенного вещества являются акцепторами электронов, а растворители (Н2О, NН3) — донорами электронов (например, образование аквакомплексов), а также в результате образования водородных связей (например, растворение спирта в воде).
Доказательствами химического взаимодействия растворенного вещества с растворителем являются тепловые эффекты и изменение окраски, сопровождающие растворение.
Например, при растворении гидроксида калия в воде выделяется теплота:
KОН + xН2О == KОН·(Н2О)x, —55 кДж/моль
а при растворении хлорида натрия теплота поглощается:
NаСl + xН2О = NаСl·(Н2О)x; +3,8 кДж/моль
Теплоту, выделяемую или поглощаемую при растворении 1 моль вещества, называют теплотой растворения Qраств.
Растворение в воде безводного меди сульфата белого цвета приводит к появлению интенсивной голубой окраски. Образование сольватов, изменение окраски, тепловые эффекты, как и ряд других фактов, свидетельствуют об изменении химической природы компонентов раствора при его образовании.
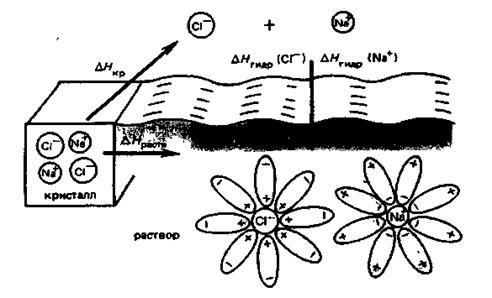
Рис. 4.3. Растворение кристалла NaCl в воде
Таким образом, в соответствии с современными представлениями растворение — физико-химический процесс, в котором играют роль как физические, так и химические взаимодействия.
 2020-09-24
2020-09-24 869
869








