Внутренняя сфера комплекса в значительной степени сохраняет стабильность при растворении, а ионы, находящиеся во внешней сфере, легко отщепляются.
Внешняя сфера комплексного соединения может состоять из катионов, если комплексный ион является анионом, или анионов, если комплексный ион является катионом, и может совсем отсутствовать, если заряд комплекса равен нулю. Ионы внешней сферы нейтрализуют заряд комплексного иона и в твердом состоянии связаны с ним ионной связью.
Лиганды могут координироваться с центральным атомом за счет образования σ-, (σ, π)- или только многоцентровых π-связей. Соответственно их называют σ-, (σ, π)- и π-лигандами. Число σ-связей, формируемых одним лигандом с центральным атомом, называется дентатностъю (от лат. dentalus — имеющий зубы).
Если лиганды соединяются с центральным атомом одной связью, это монодентатные лиганды, двумя — бидентатные. Лиганды могут быть также тридентатными, тетрадендатными,..., полидентатными.
Наиболее важные неорганические и органические лиганды приведены в табл. 1 и 2.
Таблица 1
Важнейшие неорганические лиганды
| Формула | Название | Формула | Название |
| F- | фторо | NH2- | амидо |
| Сl- | хлоро | ONO- | нитрито |
| Br- | бромо | СО | карбонил |
| I- | иодо | NO | нитрозил |
| CN- | циано | Н2O | аква |
| SCN- | тиоцианато | NH3 | амин |
| H+ | гидро | S2O32- | тиосульфато |
| OH- | гидроксо | О2 | оксо |
Таблица 2
Некоторые органические моно- и полидентатные лиганды
| Формула | Название | Обозначение | Дентатность |
| C5H5N | пиридин | Ру | 1 |
| H2NCH2CH2NH2 | этилендиамин (1,2-этандиамин) | еn | 2 |
| H2NCH2CH2O- | коламино (2-аминоэтанолато) | col или еа | 2 |
| H2NCH2COO- | глицинато (аминоацетато) | gly | 2 |
| -ОСН2СН2O- | этиленгликолато (1,2-этандиоло) | eg | 2 |
| -ООС-СОO- | оксалато | ox | 2 |
| HN(CH2CH2NH2)2 | диэтилентриамин | dien | 3 |
| (-ООССН2)2С(ОН)СОO- | цитрато | cit | 3 |
| N(CH2CH2NH2)3 | трис(2-аминоэтил)амин | tren | 4 |
| N(CH2CH2O-)3 | триэтаноламинато | atr | 4 |
| (-OOCCH2)2NCH2CH2N(CH2COO-)2 | этилендиаминтетраацетато | edta | 6 |
Лиганды, которые могут соединяться с центральным атомом-комплексообразователем в зависимости от условий различными атомами, называются амбидентатными. Например, у лиганда SCN- координирующим атомом может быть либо S, либо N:
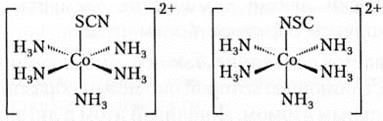
Общее число координирующих центров лигандов (атомов или л-связей), связанных с центральным атомом, другими словами валентность центрального атома, называется координационным числом (КЧ).
Координационное число атома-комплексообразователя равно сумме числа лигандов, умноженной на их дентатность.
Для комплексных соединений с монодентатными лигандами координационное число центрального атома равно числу лигандов. Например, в комплексном соединении [Pt(NH3)4Cl2]Cl2 центральным ионом-комплексообразователем является платина в степени окисления (+4); во внутреннюю сферу входят четыре молекулы аммиака, два аниона хлора. Координационное число центрального атома равно 6. Комплексный ион представляет собой катион, заряд которого равен (+2). Во внешней сфере находятся два хлорид-иона.
Координационная формула комплексного соединения может быть установлена, например, при исследовании электропроводности водных растворов таких соединений. Для определения координационной формулы комплексного соединения, находящегося в кристаллическом состоянии, может быть использован рентгеноструктурный метод. По дифракционной картине (рентгенограмме), полученной при прохождении рентгеновских лучей через кристаллические комплексные соединения, можно судить, какие атомы, ионы или молекулы образуют кристаллическую решетку, а также как они расположены в пространстве.
 2020-09-24
2020-09-24 143
143








