и его комплекс с катионом К+ (б); [2,2,2]-криптанд (в); валиномицин (г)
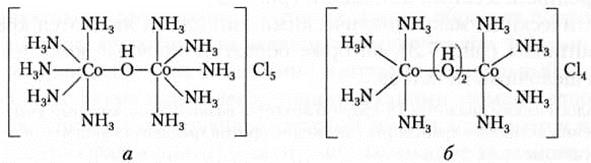
Рис. 8.4. Биядерные комплексы Со (III):
а — с одной мостиковой гидроксогруппой [(NH3)5Co—ОН—Co(NH3)5]Cl5;
б — с двумя мостиковыми гидроксогруппами [(NH3)4Co—(ОН)2—Co(NH3)4]Cl4
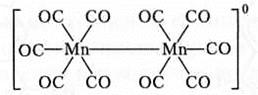
Кроме того, существуют многоядерные комплексы, содержащие непосредственно связанные между собой центральные атомы. Такие комплексы принято называть кластерами. Например, марганец образует димерный карбонил [Мn(СО)5]2. За счет непарных электронов атомов марганца образуется σ-связь Мn—Мn, соединение стабилизируется и образуется кластер [(СО)5МnМn(СО)5]:
Номенклатура координационных соединений. Согласно правилам ИЮПАК систематическое название координационного соединения может состоять из одного слова (для нейтральных комплексов) или двух слов (для катион-анионных комплексов). При этом следует придерживаться следующих правил:
· формулу комплексного иона записывают в квадратных скобках, первым указывают символ центрального атома. В названии систематические или тривиальные названия анионных, катионных и нейтральных лигандов следуют в алфавитном порядке;
· для нейтральных лигандов используют немодифицированные названия: пиридин C5H5N, метиламин CH3NH2, мочевина (NH2)2C(О) и т.д. Исключения: вода — аква -, аммиак — амин, СО — карбонил -, NО — нитрозил - и некоторые другие;
· названия анионных лигандов образуются путем замены окончаний «-ид», «-ит» или «-ат» в названиях соответствующих анионов (хлор ид, сульф ит, оксал ат и т.п.) на окончания «-о», «-ито» или «-ато» соответственно (хлор о, сульф ито, оксал ато и т.п.);
· если в состав внутренней координационной сферы входит несколько однотипных лигандов, то перед названием лиганда указывается соответствующий префикс (ди-, три-, тетра- и т.д.);
· если префикс совпадает с первыми буквами названия лиганда или может создать неопределенность при слитном написании, то название лиганда заключается в скобки, а вместо префиксов ди-, три-, тетра- и т.д. используются соответственно префиксы бис-, трис-, тетракис- и т.д., например (dien)2 — бис(диэтилентриамин), (еn)3 — трис(этилендиамин);
· центральный атом в катионных и молекулярных комплексах не имеет отличительного суффикса, например [Fe(CO)5] — пентакарбонилжелезо, [PtCl2(NH3)2]0 — диамминдихлороплатина. В анионных комплексах: латинский корень + суффикс «-ат»: Fe — ферр ат, Сu — купр ат, Ag — аргент ат, Аu — аур ат;
· название комплексного аниона образуется из названий лигандов, русского или латинского названия центрального атома и окончания «-ат», например [Fe(CN)6]4- — гексацианоферрат(II), [Аl(Н2O)2(OН)4]- — диакватетрагидроксоалюминат (III).
Приведем еще несколько примеров названий координационных соединений.
[Сr(С6Н6)2] дибензолхром
[PtBr2(en)] дибромо(этилендиамин)платина
[Co2(CO)8] октакарбонилдикобальт
[Fe(H2O)6]SO4 гексаакважелеза(II сульфат
[Ag(NH3)2]Cl диамминсеребра(I) хлорид
[CoBr(NH3)5]Br2 пентаамминбромокобальта(III) бромид
K4[Fe(CN)6] калия гексацианоферрат(II)
(NH4)2[HgI4] аммония тетраиодомеркурат(II)
Н[АuСl4] водорода тетрахлороаурат(III)
[Со(еn)3]Сl3 трис(этилендиамин)кобальта(III) хлорид
Na2[Ca(edta)] натрия этилендиаминтетраацетатокальциат
[Cu(NH3)4]2[Fe(CN)6] тетраамминмеди(II) гексацианоферрат(II)
Пространственное строение комплексных соединений. Согласно модели Кеперта, позволяющей предсказывать форму комплекса, координирующие атомы располагаются в вершинах полиэдра, в центре которого находится ион металла. Основные структурные типы основаны на:
· линейном расположении — для двух донорных атомов;
· тригональном плоском расположении — для трех донорных атомов;
· тетраэдрическом расположении — для четырех донорных атомов;
· тригонально-бипирамидальном или квадратно-пирамидальном расположении — для пяти донорных атомов;
· октаэдрическом расположении — для шести донорных атомов.
Исключением из этого правила являются некоторые четырехкоординированные комплексы, например [PtCl4]2- и [АuСl4]-, имеющие строение плоского квадрата.
Типы гибридизации, основные геометрические формы молекул или ионов и их структура приведены в табл.3.
Таблица 3
 2020-09-24
2020-09-24 125
125








