Классификация координационных соединений. Комплексные ионы могут входить в состав молекул различных классов химических соединений: кислот, оснований, солей и др. В зависимости от заряда комплекса различают катионные, анионные и нейтральные комплексы.
В катионных комплексах центральными атомами-комплексообразователем являются катионы или положительно поляризованные атомы комплексообразователя, а лигандами — анионы и нейтральные молекулы, чаще всего воды и аммиака.
Комплексные соединения, в которых лигандом выступает вода, называются аква-комплексами, например [Mg(H2O)6]Cl2, [Fe(H2O)6](NO3)3.
Один из наиболее многочисленных классов комплексных соединений – аммино-комплексы (аммиакаты) и аминаты, лигандами в которых являются молекулы аммиака или амина, например [Cu(NH3)4]SO4, [Pt(NH3)6]Cl4, [Cd(NH2CH2CH2NH2)3]Cl2.
В анионных комплексах внутренняя сфера заряжена отрицательно, а в качестве лигандов преобладают анионы.
К анионным комплексам относятся:
а) комплексные кислоты (H[BF4], H2[SiF6], H[Ag(CN)2]);
б) гидроксосоли К[Аl(ОН)4], Na2[Sn(OH)6];
в) полигалогениды: K[I(I)2], Cs[I(I2)].
К нейтральным комплексам относятся соединения, не имеющие внешней сферы и не дающие в водных растворах комплексных ионов: [Pt(NH3)2Cl4], [Co(NH3)3(NO2)3], [Fe(CO)5], [W(CO)6].
Некоторые комплексные соединения могут одновременно содержать как комплексный катион, так и комплексный анион, например [Pt(NH3)4][PtCl4], [Ni(NH3)6][Fe(CN)6].
Хелатные комплексы (хелаты) — устойчивые комплексы металлов с полидентатными лигандами, в которых лиганд образует с атомом-комплексообразователем один или несколько гетероциклов. Иными словами, хелаты — координационные соединения, в которых центральный атом связан одновременно с двумя или более координирующими атомами одного и того же лиганда. Лиганды, образующие хелатные циклы, называются хелатирующими (хелатообразующими) реагентами. Замыкание хелатного цикла такими лигандами называется хелатированием (хелатообразованием). Наиболее обширный и важный класс хелатов — хелатные комплексы металлов. Способность координировать лиганды присуща металлам всех степеней окисления.
Хелатирующие реагенты содержат два основных типа электронодонорных центров:
а) группы, содержащие подвижный протон, например —СООН, —ОН, —O3Н; при их координации к центральному иону возможно замещение протона;
б) нейтральные электронодонорные группы, например —C(O)R, —NR2.
Обычно комплексы, содержащие хелатирующие лиганды, обладают повышенной устойчивостью по сравнению с комплексами, не содержащими таких лигандов.
Согласно правилу циклов Чугаева наиболее устойчивые хелатные комплексы образуются в том случае, когда в состав цикла входит пять или шесть атомов.
Так, в случае диаминов H2N—(СН2)n—NH2 наиболее устойчивые комплексы образуются для n = 2 (пятичленный цикл) и n = 3 (шестичленный цикл).
Хелаты, в которых при замыкании хелатного цикла лиганд использует и протон-содержащую, и нейтральную группы и связан с центральным атомом ковалентной и донорно-акцепторной связью, ранее назывались внутрикомплексными соединениями. Такие соединения могут образовывать полидентатные лиганды с кислотными функциональными группами.
Внутрикомплексные соединения — это хелаты, замыкание цикла в которых сопровождается вытеснением из кислотных функциональных групп одного или нескольких протонов ионом металла.
В частности, внутрикомплексным соединением является глицинат меди (II):
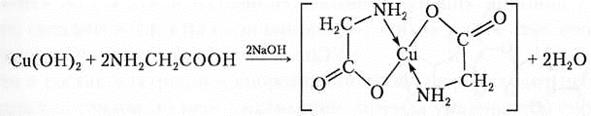
В отдельную группу выделяют комплексы с макроциклическими лигандами. Макроциклические лиганды — это гетероциклические соединения, содержащие несколько донорных атомов, связанных мостиками таким образом, что образуется полость определенного размера. Такие лиганды образуют еще более устойчивые комплексы.
Гемоглобин и хлорофилл (зеленый пигмент растений, ответственный за процесс фотосинтеза) также являются внутрикомплексными соединениями с макроциклическими лигандами (рис. 8.2).
Синтетическими макроциклическими лигандами являются краун-эфиры и криптанды (рис. 8.3), которые образуют прочные комплексы даже с ионами щелочных металлов.
Биологическим аналогом 18-краун-6 является валиномицин, который участвует в осуществлении активного транспорта (движение против градиента концентрации) катионов К+ в организме.
Комплексы, в которых лиганды связывают два или более центральных атомов, называются биядерными и соответственно полиядерными. В качестве примера можно привести биядерные комплексы кобальта (III):
с одной мостиковой гидроксогруппой — [(NH3)5Co(μ-OH)Co(NH3)5]Cl5 и
с двумя мостиковыми гидроксогруппами — [(NH3)4Co(μ-OH)2Co(NH3)4]Cl4 (рис. 4).
Символ «μ» перед формулой или названием лиганда указывает на то, что данный лиганд является мостиковым
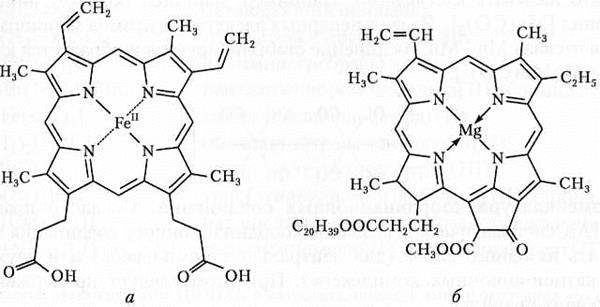
Рис. 8.2. Гем — простетическая группа гемоглобина (а)
 2020-09-24
2020-09-24 171
171








