Для быстрого, но приближенного определения плотности служит ареометр.
Он представляет собой поплавок с дробью или ртутью и узким отростком-трубкой, в которой находится шкала с делениями. Ареометр погружается в различных жидкостях на различную глубину. При этом он вытесняет объемы этих жидкостей одной и той же массы, равной массе ареометра, а, следовательно, обратно пропорциональные их плотности. То деление шкалы, до которого ареометр погружается в жидкость, показывает плотность этой жидкости. В зависимости от заданной точности применяют один ареометр с большими интервалами на шкале или набор нескольких ареометров с мелкими делениями.
Ареометры, применяемые для определения плотности жидкостей тяжелее воды, имеют нуль вверху шкалы, а для жидкостей легче воды – внизу шкалы.
От плотности растворов можно перейти к массовой доле, пользуясь специальными таблицами. Если в таблицах не имеется цифры, точно отвечающей сделанному отсчету на шкале ареометра, а есть близкие величины (немного больше и немного меньше), то массовую долю растворенного вещества вычисляют методом интерполяции (определение промежуточной величины по двум известным крайним).
Определяют массовую долю методом интерполяции по следующей формуле:
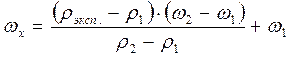 ,
,
где rэксп. – экспериментально определенная плотность, которой соответствует концентрация ωx в %,
r1 – плотность раствора ближайшего меньшего значения концентрации (ω1),
r2 – плотность раствора ближайшего большего значения концентрации (ω2).
Вопросы к допуску
1. дать определение растворам. Назвать главные характеристики растворов.
2. Что называется концентрацией раствора?
3. Перечислить все известные способы выражения концентрации растворов.
4. Что такое молярность, моляльность, нормальность раствора и массовая доля?
5. Какая масса Na2CO3·10H2O потребуется для приготовления 50 г 5 %-го раствора в расчете на водную соль?
6. Рассказать принцип работы ареометра.
7. Рассчитать какое количество из BaCl2·2H2O требуется для приготовления 50 мл 0,5 н. раствора хлорида бария?
8. Какой объем 96 %-й серной кислоты потребуется для приготовления 50 мл 1 М раствора H2SO4 (плотность 1,84 г/мл).
9. Объяснить метод интерполяции.
ОПЫТ №1. Приготовление растворов с заданной массовой долей (из твердого вещества и воды).
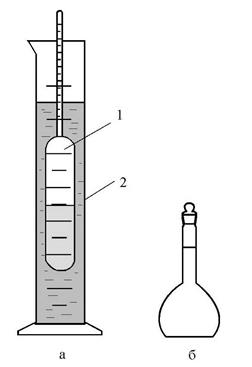
Приготовить 50 г 5 %-го раствора карбоната натрия из кристаллической соды Na2CO3·10H2O и воды. Вычислить, какое количество Na2CO3·10H2O требуется для приготовления 50 г 5 %-го раствора в расчете на водную соль. Отвесить это количество измельченной соды в предварительно взвешенном стаканчике на электронных весах с точностью до 0,01 г. Рассчитать, какой объем воды необходим для растворения взятой навески. Отмерить мерным цилиндром этот объем воды. Вылить воду в стакан и растворить в ней отвешенную соль. Измерить температуру приготовленного раствора, если она не равна температуре, которая указана в таблице 6, довести ее до указанной величины, нагревая или охлаждая раствор. Вылить раствор в сухой высокий узкий цилиндр и опустить в него сухой ареометр так, чтобы он не касался стенок сосуда (рис. 14). Отметить то деление шкалы, которое совпадает с нижним мениском жидкости в цилиндре, произведя отсчет по шкале сверху вниз. Ареометр промыть водой, осторожно вытереть досуха и сдать лаборанту. Раствор вылить в приготовленную склянку для слива раствора.
 | По найденной плотности, пользуясь таблицей 6, определить массовую долю карбоната натрия в растворе. Если в таблице нет этой величины плотности, а есть немного меньшая и большая, то вычислить массовую долю, используя метод интерполяции. Сравнить полученную величину с заданной концентрацией раствора. Рассчитать молярную концентрацию и молярную концентрацию эквивалента приготовленного раствора. |
| Рис. 14. Приборы для определения плотности: а – ареометр 1 (2 – цилиндр); б – пикнометр |
 2020-09-24
2020-09-24 1838
1838
