I. Рассчитаем рН буферного раствора на примере ацетатного буфера:
СН3СООН + СН3СООNa
СН3СООН <=> CH3COO- + H+
Kдис = [CH3COO-] ∙ [H+] / [CH3COOH]
[H+] = Kдис ∙ [CH3COOH] / [CH3COO-]
[CH3COOH] = C кислоты
[CH3COO-] = C соли
-lg[H+] = - lg Kдис – lg C кислоты / С соли
рН = рКа – lg C кислоты /С соли
Если соль и кислота взяты в разных объемах, то формула имеет следующий вид:
рН = рКа – lg (C кислоты ∙ V кислоты) / (Cсоли ∙ V соли)
С - молярная концентрация эквивалента.
рКа – силовой показатель кислоты
II. Для аммиачного буфера:
рН = 14 – рКв + lg (C кислоты ∙ V кислоты) / (C соли ∙ V соли)
рКв – силовой показатель основания.
Наиболее часто применяют буферные растворы с концентрацией компонентов 0.1 н.
Механизм буферного действия
Буферное действие этих растворов объясняется их способностью связывать как ионы Н+, так и ОН-.
1. Пример ацетатного буфера:
a) Добавляем кислоту:
СН3COONa + HCl → C H3COOH + NaCl
CH3COO- + Na+ + H+ + Cl- → CH3COOH + Na+ + Cl-
CH3COO- + H+ → CH3COOH
Добавили сильную кислоту, получилась слабая кислота, рН не изменится.
в) Добавляем щелочь:
СH3COOH + NaOH → CH3COONa + H2O
CH3COOH + Na+ + OH- → CH3COO- + Na+ + H2O
CH3COOH + OH- → CH3COO- + H2O
Добавили сильную щелочь, получился слабый электролит – вода, рН не изменится.
2. Пример аммиачного буфера:
a) Добавляем кислоту:
NH4OH + HCl → NH4Cl + H2O
NH4OH + H+ + Cl- → NH4+ + Cl- + H2O
NH4OH + H+ → NH4++H2O
Добавили кислоту, получился слабый электролит – вода, рН не изменится.
в) Добавляем щелочь:
NH4Cl + NaOH → NH4OH + NaCl
NH4+ + Cl- + Na+ + OH- → NH4OH + Na+ + Cl-
NH4+ + OH- → NH4OH
Добавили щелочь, получился слабый электролит гидроксид аммония, рН не изменится.
Вывод: таким образом, способность буферного раствора поддерживать практически постоянной величину рН основана на том, что один компонент раствора связывает ионы [Н+], а другой [OH-]
Разбавление буферного раствора или его концентрирование путём выпаривания не влияет на pH, т.к. при этом меняется концентрация компонентов буфера, но их отношение остается неизменным.
Буферная ёмкость
Способность буферных растворов сохранять постоянство pH небезгранична. Предел, в котором проявляется буферное действие называется буферной ёмкостью (B). Она определяется количеством эквивалентов сильной кислоты или щелочи, которое надо добавить к 1 литру буферного раствора, чтобы его pH изменился на 1.
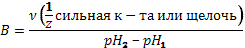
где 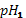 исходное значение,
исходное значение, 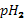 значение после добавления щелочи или кислоты.
значение после добавления щелочи или кислоты.
Буферная ёмкость тем выше, чем больше концентрация компонентов буферного раствора. Наибольшей буферной емкостью обладают растворы с одинаковой концентрацией компонентов. В таких растворах всегда 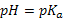 или
или 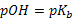 . Разбавление буферного раствора не влияет на его pH, но сильно сказывается на его буферной ёмкости, она уменьшается.
. Разбавление буферного раствора не влияет на его pH, но сильно сказывается на его буферной ёмкости, она уменьшается.
 2020-09-24
2020-09-24 228
228








