I. Кислоты – это электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода.
HCl <=>H+ + Cl-
Многоосновные кислоты диссоциируют ступенчато:
H2SO4<=>H+ + HSO4-; HSO4-<=> H+ + SO42-
Общий ион H+, придает окраску индикаторам.
II. Основания – это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы ОН−.
NaOH <=> Na+ + ОН −
Многокислотные основания диссоциируют ступенчато:
Ba(OH)2 <=> BaOH++ ОН −; BaOH+<=>Ba2++ ОН −
Анионы ОН − придают окраску индикаторам.
III. Соли – это электролиты, при диссоциации которых образуются катионы металла и анионы кислотного остатка.
Средние соли: NaCl <=> Na+ + Cl-
Кислые соли: NaHSO4<=> Na+ + HSO4-; HSO4- <=> H+ + SO42-
Основные соли: BaOHCl<=> BaOH++ Cl-; BaOH+ <=>Ba2++ ОН −
Общих ионов нет, индикаторы не изменяют окраску.
Процесс электролитической диссоциации веществ в водных растворах количественно характеризуется двумя величинами:
1. степенью электролитической диссоциации - a,
2. константой диссоциации - Кдис.
I. Степень диссоциации (a) – это отношение числа молекул, распавшихся на ионы к общему числу молекул.
Факторы, влияющие на степень диссоциации:
1. Природа растворенного вещества, тип связи (чем полярнее связь, тем легче идет диссоциация).
2. Природа растворителя (чем больше величина диэлектрической проницаемости ε, тем легче идет диссоциация).
3. Концентрация (При разбавлении a увеличивается a= 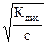 ).
).
4. Температура (с увеличением температуры a растет до определенной величины, затем уменьшается)
5. Влияние одноименного иона (вводимый в систему одноименный ион подавляет диссоциацию слабого электролита).
По величине степени диссоциации электролиты делятся на:
1. Сильные, у которых α > 30%: соли, некоторые кислоты - HClO4, H2SO4, HNO3, HI, HBr, HCl, гидроксиды щелочных металлов, гидроксиды щелочно-зельных металлов: кальция, стронция и бария.
2. средние 30% < a <5%: H3PO4
3. слабые, у которых a <5%: H2O, HCN, NH4OH.
II. Константа диссоциации (Кдис) – это константа равновесия процесса диссоциации.
Рассмотрим равновесие в растворе слабого электролита.
KA «K+ + A-
Пусть: концентрация раствора С моль/л,a- степень диссоциации. Тогда: концентрация недиссоциированных молекул [KA]= с(1-a), а концентрация каждого из ионов [K+]=[ A-]= сa. Тогда выражение для константы диссоциации принимает вид:

Это уравнение представляет собой закон разбавления Оствальда. Оно позволяет определять степень диссоциации при разных концентрациях электролита, если определена его константа диссоциации; также константу диссоциации электролита, если известна его степень диссоциации при какой-либо концентрации.
Для растворов, в которых диссоциация электролита очень мала, a<<1, и, следовательно, этой величиной можно пренебречь в знаменателе правой части уравнения. Тогда это уравнение примет следующий вид:
Кдис@a2·с или a=  .
.
Таким образом, степень диссоциации возрастает при разбавлении раствора.
 2020-09-24
2020-09-24 920
920








