Кислотно - щелочной баланс в крови человека и животных обеспечивается рядом буферных растворов:
1. Водородкарбонатный буферный раствор: H2CO3 +NaHCO3
2. Карбонатный буферный раствор: CO2 + Ca(HCO3)2; CO2 + Mg(HCO3)2
Эти растворы эффективно компенсирует действие веществ, увеличивающих кислотность крови, например, молочной кислоты, избыток которой образуется при интенсивной физической нагрузке.
3. Фосфатный буферный раствор – играет более важную роль в клетках крови, чем в её плазме: CaHPO4 + Ca(H2PO4)2
4. Белковый (аминокислотный) буферный раствор – нейтрализует как кислые, так и основные продукты обмена веществ. Аминокислоты и белки относятся к амфотерным соединениям. Поэтому они образуют буферные растворы 2-х типов: слабая кислота и ее соль; слабое основание и его соль.
Значение буферных растворов
В природе буферные растворы обеспечивают химическую устойчивость и нормальную работу ферментативных систем. Многие ферменты могут функционировать в узких диапазонах pH. Изменение pH на 0.4 единицы гибельно для живых организмов, происходит денатурация белка.
| Природные буферные системы | pH |
| Кровь человека | 7.35 – 7.45 |
| Слюна | 6.35 – 6.85 |
| Молоко | 6.6 – 6.9 |
К естественным буферным растворам относятся также почвенные растворы за счет содержащихся в них электролитов. Они создают благоприятные условия для развития растений, которые могут развиваться при определенных значениях pH почвы. При pH > 9 и pH<3 протоплазма клеток в корнях растений сильно повреждается. Буферная емкость почвы определяет ее экологическую устойчивость несмотря на неблагоприятное действие кислотных дождей.
| Почва | pH их почвенных растворов |
| Подзолистая | 3.5 - 6 |
| Серая лесная | 5.5 - 6.5 |
| Чернозём | 6.5 - 7 |
| Солончаковые | 8 - 9 |
Гидролиз солей
Гидролизом солей называется обменная реакция ионов соли с молекулами воды, в результате которой смещается равновесие диссоциации воды и часто изменяется рН растворов.
Согласно современным представлениям о механизме диссоциации ионы в водном растворе окружены гидратной оболочкой.
Катионы удерживают свою гидратную оболочку за счет донорно-акцепторной связи.
 Катионы - акцепторы электронных пар атома кислорода:
Катионы - акцепторы электронных пар атома кислорода:

 Н Z+
Н Z+
Katz+ ← О
 Н
Н
Анионы удерживают свою гидратную оболочку за счет водородной связи:


 Anz-.... H Z-
Anz-.... H Z-
 О
О
Н
Исходя из этого, гидролиз является результатом поляризационного взаимодействия ионов соли с их гидратной оболочкой.
Гидролизу подвергаются соли, образованные:
1. слабым основанием и сильной кислотой;
2. сильным основанием и слабой кислотой;
3. слабой кислотой и слабым основанием;
4. соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются
I. Под действием электрического поля иона соли в молекуле воды происходит перераспределение зарядов, и молекула воды становится более полярной, связи в ней разрываются. Этот процесс для катионов можно представить так:


 Н Z+
Н Z+
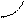
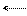
 Katz+←О → [ Kat OH](z-l)+ + H+
Katz+←О → [ Kat OH](z-l)+ + H+
Н
Представленная схема имеет место при гидролизе соли по катиону (соли образованы слабыми основаниями и сильными кислотами).
Существуют соли:
а) однозарядных катионов NH4+, Cu+;
б) двухзарядных Си2+, Zn2+, Cd2+, Mn2+...
в) трехзарядных А13+, Cr3+, Fe3+;
Пример: Рассмотрим гидролиз соли хлорида цинка. Так как катион Zn2+ двухзарядный, гидролиз идет ступенчато. По второй ступени гидролиз идет незначительно.
1ступень:
Ионное уравнение: Zn2+ + Н2О <=> (ZnOH)+ + Н+
Молекулярное уравнение: ZnCl2 + Н2О <=> ZnOHCl + HC1
2ступень:
ZnOH+ + Н2О <=> Zn(OH)2 + Н+
ZnOHCl + Н2О <=> Zn(OH)2 + HCl
Ионное уравнение показывает:
а) гидролизу подвергся катион Zn2+
б) в результате реакции гидролиза накапливаются ионы Н+, которые сообщают среде кислую реакцию (рН<7).
II. Гидролиз по аниону (соли образованы сильными основаниями и слабыми кислотами). Взаимодействие силового поля анионов с гидратной оболочкой:


 Н Z-
Н Z-

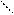 Anz-... O <=> HAn(z-l)-+ ОН-
Anz-... O <=> HAn(z-l)-+ ОН-
Н
Существуют соли:
а) однозарядных анионов CN ¯, СlO ¯
б) двухзарядных анионов S2-, SO32-, СО3 2-
б) трехзарядных анионов ВО33-, СrО33-
Пример: Рассмотрим гидролиз соли Na2S. Анион S2- двухзарядный, поэтому идет двухступенчатый гидролиз:
1 ступень: 2 ступень:
S2- + Н2О <=> HS- + ОН- HS- + Н2О<=>H2S + ОН-
Na2S + Н2О <=> NaHS + NaOH NaHS + Н2О <=> H2S + NaOH
Ионные уравнения показывают, что:
а) гидролизу подвергаются анионы S2-
б) в результате гидролиза накапливаются ионы ОН-, которые сообщают среде щелочную реакцию рН > 7.
 2020-09-24
2020-09-24 259
259








