“Кислород - это та ось, вокруг которой вращается химия” - Берцеллиус
Кислород – самый распространенный элемент литосферы -75%(в виде силикатов и алюмосиликатов), в гидросфере -86%, в атмосфере 21% по объему. 1200 минералов содержат кислород.
Аллотропия кислорода: Кислород существует в виде двух аллотропных модификаций: кислород и озон.
Кислород -газ, без цвета, без запаха, t кип.=-183◦С, t пл.=-219◦С,в сжиженном состоянии – бледно-голубая жидкость, в 100 л H2O растворяется 3.1 объема O2.Специфическая особенность молекулы O2 –парамагнетизм, обусловленный наличием двух неспаренных электронов, O2- втягивается в магнитное поле. Кислород – сильный окислитель.
Озон – газ, голубой, резкий запах, t кип.=-112◦С, t пл.=-193◦С, в сжиженном состоянии – бледно-голубая жидкость, в твердом - темно-фиолетовые кристаллы, в воде растворим лучше, чем кислород. Озон – более сильный окислитель, чем кислород.
Получение: О2 в чистом виде существует в природе. Озон образуется при низких температурах, при разряде молнии.
3О2 = 2О3 - Q
В лаборатории кислород получают по реакции:
2KMnO4→ K2MnO4 + MnO2+ О2
Соединения кислорода
1) Перекись водорода. Степень окисления -1. Может быть и окислителем и восстановителем.
O2 + 2H++ 2e ® 2H2O2 Eo= 0.682В
H2O2 + 2H+ + 2e ® 2H2O Eo=1.776В - очень сильный окислитель.
В воде нестабильна, диспропорционирует.
2) Сжигая щелочные металлы в кислороде, получаем перекиси металлов. Ион О22- диамагнитен.
O2+2Na →Na2O2
3) Сжигая тяжелые щелочные металлы (начиная с К) под давлением кислорода, получаем надперекиси КО2. Ион О2- парамагнитен, 1 неспаренный электрон.
O2+K →KO2
4) Озон образует озониды: 3KOHтв + 2O3 ® 2KO3(тв)+KOH×H2O + 1/2O2. Соединения непрочные, сильнейшие окислители.
5) Кислород обратимо присоединяется к оксигенильным комплексам - гемоглобину, гемоцианину. Поиски искусственной крови.
Остальные элементы VI группы
Сера. В земной коре 0.1%. Встречается в виде:
1) самородная сера в виде молекул S8;
2) сульфидные руды: FeS2 – пирит, PbS, ZnS, HgS, FeS, CuS и другие сульфиды. Селен и теллур встречаются в виде селенидов и теллуридов металлов.
3) Сульфатные руды: CaSO4∙2H2O – гипс, Na2SO4∙10H2O – глауберова соль, MgSO4∙7H2O-горькая соль.
4) H2S – сероводородные источники.
5) Сера входит в состав белков.
Для элементов VI группы характерна тенденция к образованию цепей - образование двойной связи как у кислорода становится все менее выгодно с увеличением размеров атомов, а наличие двух неспаренных р-электронов благоприятствует образованию длинных зигзагообразных цепей. Отсюда S8 -
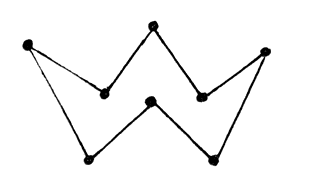
| т.н. корона. При нагревании она плавится и повышается вязкость - образуются более длинные цепи. Аллотропия серы. Сера имеет различные структуры: ромбическую и моноклинную. Sромб (a) DHfo=0 95.6oC®Sмон (b) DHo=- 0.38 кДж |
При нагревании выше 160 oC циклы разрываются и образуется пластическая сера, представляющая собой полимерную структуру. Таким образом, сера существует в виде трех аллотропных модификаций: ромбическая, моноклинная и пластическая сера. t пл.=119.3◦С; t кип.=445◦С. В парах при 900◦С сера существует в виде S2, только выше 1500 ◦С - S.
 2020-09-24
2020-09-24 148
148








