Химические свойства серы и ее соединений можно легко объяснить, пользуясь ее шкалой степеней окисления:
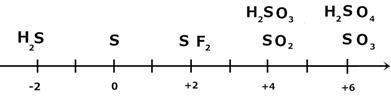
1) S в окислительно-восстановительных реакциях может быть как окислителем, так и восстановителем.
2) H2S –только восстановитель;
3) SO3, H2SO4 – только окислители; в разбавленном (1 М) растворе H2SO4 очень плохой окислитель.
4) SO2, H2SO3 – могут быть как окислителями, так и восстановителями. Обычно H2SO3 и ее соли используются как хороший, мягкий восстановитель
Изменение окислительно-восстановительных свойств соединений вниз по группе:
1) Растет восстановительная активность Н2Э.
2) Падает окислительная активность Э.
3) SeO42- самый сильный окислитель; - вторичная периодичность.
Водородные соединения
| Ткип,оС | DHfo,кДж/моль | Кд(I) | Ð связи | Ео(Э/Э2-) | |
| H2O | 100 | -241.6 | 1.8×10-16 | 105 | 1.229 |
| H2S | -60 | -20.1 | 0.87×10-7 | 92 | 0.142 |
| H2Se | -41 | +86 | 1.9×10-4 | 91 | -0.40 |
| H2Te | -2 | +154.2 | 2.3×10-3 | 90 | -0.72 |
Стабильность падает по группе, межатомные взаимодействия растут (как и в VII группе). Исключение - вода. Опять неординарные свойства первого элемента группы - водородные связи между молекулами воды стабилизируют воду в целом и приводят к тому, что она жидкая при стандартных условиях.
H2S – газ, бесцветный, запах тухлых яиц, токсичен, t кип.= -60◦С, t пл.= -86◦С, неустойчивое соединение. H2S - яд. Противоядие - окислители.
Получение H2S:
Обычно получают, как и остальные халькогеноводороды по реакции:
FeЭ + H2SO4 ® FeSO4 + Н2Э
Н2Э -кислоты, но в отличие от VII группы, слабые. Сила кислот растет по группе. Восстановители. H2Se и H2Te восстанавливают воду.
Взаимодействие с кислородом:
1) при избытке кислорода: 2H2S + 3O2® 2SO2 + 2H2O
2) при недостатке кислорода: 2H2S + O2® 2S + 2H2O
Высокой прочностью связи S-S объясняется существование полисульфидов водорода (сульфанов): H2S2, H2S3, H2S4, которые имеют цепочечное строение: H-S-S-S-S-H.
Сульфаны – желтые, вязкие маслообразные жидкости с резким запахом. Это более сильные кислоты, чем H2S (KI= 10-4).
Полисульфиды: Na2S + (n-1)S →Na2Sn
Полисульфиды Na, K, Ca, Ba, NH4+ пестициды с широким диапазоном действия.
Сульфиды металлов
H2S, слабая кислота: KI= 10-7, K2=10-14.
Растворимы только сульфиды щелочных металлов. Осаждение сульфидов - способ разделения металлов в аналитической химии. Сульфиды выпадают в осадок при разных рН, в зависимости от их произведения растворимости.
Ag2S ПР=2.0×10-50; CdS ПР=1.6×10-28; Bi2S3 ПР=1.0×10-97
СuS ПР=6.3×10-36; HgS ПР=1.6×10-52; PbS ПР=2.5×10-27.
Эти сульфиды осаждаются в кислой среде.
СoS ПР=4×10-21; FeS ПР=5×10-18; MnS ПР=2.5×10-10; NiS ПР=3.2×10-19
Эти сульфиды осаждаются в щелочной среде (Na2S).
Качественная реакция на сульфид – ион:
1) осаждение соли CdS –желтого цвета;
2) действие кислоты на сульфид - появляется запах H2S.
Оксиды
ЭО2, ЭО3. У серы еще S2O3, SO, S2O7, SO4.
S + O2 ® SO2
SO2 + H2O «H2SO3 - слабая кислота К1=1.3 ×10-2, К2 = 10-8
SO2 + 1/2O2 ® SO3 DH=-97.5 кДж
| DHfo,(ЭО2) кДж/моль | DHfo(ЭО3), кДж/моль | |
| S | -295 | -439(ж) |
| Se | -235(кр) | -173(кр) |
| Te | -324(кр) |
ЭО2 - понижается стабильность от S к Se, но повышается к теллуру.
У всех оксидов понижается кислотность, возрастают основные свойства. ТеО2 - амфотерный оксид.
H2SO4, но H6TeO6 по тем же причинам, что и у иода, слабая кислота.
Обилие кислородных кислот серы. Систематизируем.
1) Кислоты с одним атомом серы - H2SO3 и H2SO4.
2) С двумя и более атомами серы
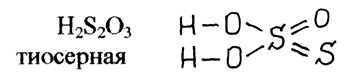
очень хороший восстановитель
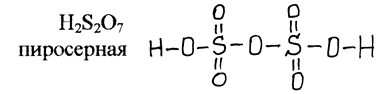
Политионовые кислоты (сохраняется цепочка атомов серы)
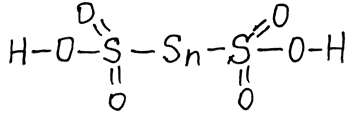
3) Производные перекиси водорода
пероксомоносерная пероксодисерная
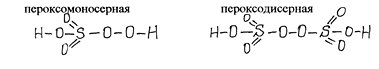
Из кислот серы важнейшее значение имеет серная кислота.
 2020-09-24
2020-09-24 219
219








