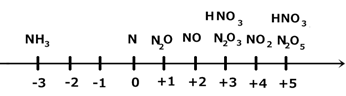
1) NH3 – в реакциях только восстановитель;
2) HNO3 –только окислитель;
3) N2 и все оксиды азота – могут быть и окислителями и восстановителями.
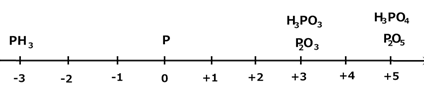
1) PH3 - в реакциях только восстановитель;
2) P2O5 и H3PO4–только окислители;
3) P, P2O3 и H3PO3 – могут быть и окислителями и восстановителями.
| DНfo, кДж/моль | ÐНЭН | |
| NH3 | -46.2 | 107.3 |
| PH3 | +9.6 | 93.3 |
| AsH3 | +66 | 92 |
| SbH3 | +145 | 91 |
| BiH3 | малоизучен | |
Стабильность водородных соединений падает, угол связи приближается к 90о - уменьшается гибридизация. Непосредственно из элементов можно получить только аммиак, и тот находится в равновесии с реагентами.
Получение M3Э + HCl ® ЭH3 + MCl
Э2O3 + Zn + HCl ® ЭH3 + ZnCl2 + H2
Аммиак (NH3) - слабое основание в воде NH3×H2O «NH4+ + OH- K=2×10-5;
может вести себя как кислота NH3 «NH2- + H+, давая соли: амиды - NaNH2; имиды - Na2NH; нитриды Na3N
Фосфин (PH3) - как основание K=10-26, как кислота K=10-29. Остальные вообще инертны. Обратите внимание на общую тенденцию при движении по периоду справа налево: HF - слабая кислота, H2O - амфотерна, NH3 - преимущественно основание.
Восстановители
Аммиак окисляется кислородом до азота или, на платине в качестве катализатора до NO, восстанавливает металлы (медь), реагирует с хлором:
4NH3 +3O2 ® 2N2 + 6H2O
4NH3 +5O2 ® 4NO + 6H2O (в присутствии Pt; NO – используется при производстве HNO3)
3Cl2+2NH3®N2 + 6HCl
Аммиак - донор электронной пары - основание Льюиса. Реакции присоединения проходят по донорно-акцепторному типу. При движении вниз по группе донорные свойства ослабевают - электронная пара сохраняет практически s-характер.
NH3 + HCl ® NH4Cl хлорид аммония
NH3 + H2O ® NH4OH гидроксид аммония
Фосфин реагирует аналогично.
Окисленные формы
Наибольшее количество оксидов имеет азот. При этом можно ожидать, что все они будут непрочными, т.к. для их получения нужно разорвать связь в молекуле азота. Смотрим в термодинамический справочник:
| N2O | NO | N2O3 | NO2 | N2O5(кр) | |
| DНfo, кДж/моль | +82.0 | +90.25 | +83.3 | +33.5 | -43 |
В молекуле NO кратность связи 2.5 (см. схемы МО для двухатомных молекул). Молекулярный ион нитрозония NO+ прочнее, связь короче. Существует соль гидросульфат нитрозония NOHSO4.
Из всех оксидов только N2O3 и N2O5 - кислотные, остальные - несолеобразующие.
N2O - веселящий газ, используется для наркоза. Легко разлагается, выделяя кислород. NO и NO2 - молекулы с неспаренными электронами - радикалы, могут димеризоваться. NO димеризуется плохо, 2NO2«N2O4 - реакция экзотермическая. Подумайте, почему дым из заводских труб летом желтый, а зимой белый.
N2O3: KNO2 + H2SO4 ® N2O3 + H2O + KHSO4. Ангидрид слабой азотистой кислоты.
N2O5 - единственный экзотермический оксид азота (но только кристаллический, в газе DНfo=+12 кДж/моль). В кристалле имеем соль - нитрат нитрония NO2+NO3-. Азот не может быть более чем четырехвалентным - нет электронов и орбиталей для этого. Поэтому связь в нитрат - ионе трехцентровая порядок не целочисленный, но степень окисления остается +5.
 2020-09-24
2020-09-24 729
729








