Кислород включается в метаболические превращения аэробных организмов по различным механизмам. К ним относятся, например, окислительное фосфорилирование, фотофосфорилирование и окислительные превращения в нормальном метаболизме и в биотрансформации ксенобиотиков. В случае окислительных превращений различные оксигеназы вводят в структуру субстратов один или два атома кислорода. В частности, оксигеназы смешанных функций, представляющие собой гемопротеины, окисляют СН‑связи с образованием гидроксилированных производных, а двойные связи могут окисляться с образованием эпоксидов (см. гл. 12). В окислительном фосфорилировании идет перенос электронов от восстановленного никотинамидадениндинуклеотида на молекулы кислорода дискретными этапами с четко фиксированными окислительно-восстановительными потенциалами. В этом процессе, связанном с прямым восстановлением молекулы кислорода четырьмя электронами, образуется вода.
Процессы переноса электронов на кислород находятся под строжайшим ферментативным контролем, обеспечивающим полное восстановление кислорода до воды или его включение в органические молекулы. Электронная конфигурация молекулы кислорода соответствует бирадикалу и поэтому его восстановление до воды гораздо легче протекает по схеме последовательного присоединения, чем при согласованном переносе четырех электронов. Однако последовательное одноэлектронное восстановление приводит к реакционноспособным промежуточным состояниям кислорода, которые в небольшом количестве всегда сопровождают течение нормального метаболизма:



При переносе на молекулу кислорода нечетного числа электронов образуются свободные радикалы, из которых самым реакционноспособным является гидроксильный радикал. Он значительно легче реагирует с органическими молекулами, чем менее реакционноспособные пероксид и супероксид, при этом супероксид легко диспропорционирует на пероксид и кислород в присутствии супероксиддисмутазы:
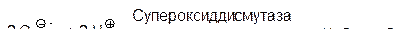
Гидроксильный свободный радикал – это мощный и неизбирательный окислитель, реагирующий с органическими веществами, входящими в состав клеток, с константами скорости порядка 1×109 ÷ 1×1010 моль–1·с–1. Вызываемое гидроксильным радикалом окисление представляет собой отрыв электрона от органической молекулы с образованием из нее свободного радикала, который с участием кислорода превращается в гидропероксид, генерируя при этом в цепной реакции множество новых свободных радикалов, то есть идет реакция инициации и распространения цепи:
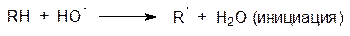
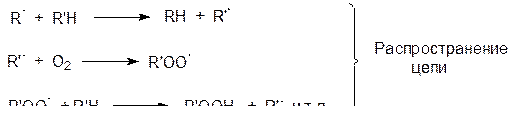
Обрыв цепи происходит в результате рекомбинации различных радикалов, в том числе и с образованием пероксидов, например ROOR¢.
Ярче всего цепные реакции окисления проявляются на липидных компонентах клеточных мембран, где объектом атаки свободных радикалов становятся метиленовые группы между двойными связями в остатках полиненасыщенных кислот:
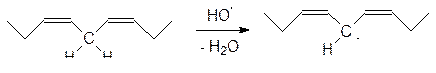
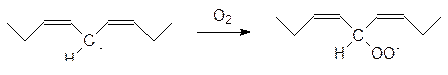
Затем образовавшийся пероксидный радикал отрывает атом водорода от другой метиленовой группы, превращается в гидропероксид и генерирует новый свободный радикал, который продолжает цепь свободно-радикальных превращений:

Накапливающиеся гидропероксиды окисляют другие ненасыщенные остатки по двойным связям. Одним из продуктов этого окисления становится диальдегид малоновой кислоты, присутствие которого обнаруживается специальной цветной реакцией, позволяющей количественно определять степень окислительного повреждения мембранных липидов:
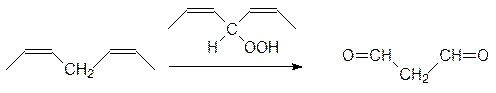
Укороченные и гидрофилизированные окислительными превращениями остатки жирных кислот в составе мембранных липидов не могут больше участвовать в поддержании структуры двухслойной мембраны и она лизируется, что приводит к гибели клетки.
Свободные радикалы сильно различаются по стабильности и реакционной способности. В частности, витамин Е и многие другие фенольные соединения с объемными заместителями, принимая неспаренный электрон, делокализуют его в ароматической системе. Такие свободные радикалы не принимают участия в инициации и распространении цепи.
Продукты неполного восстановления молекул кислорода, органические пероксидные свободные радикалы и пероксидные соединения часто объединяют названием активный кислород. Кроме того, существует еще так называемый синглетный кислород. При спонтанных изменениях спина электрона обычный триплетный кислород, который из-за несоответствия электронных характеристик молекул плохо реагирует с синглетными органическими молекулами, переходит в синглетное состояние и становится более сильным окислителем. В процессе фотосинтеза образуется также триплетный хлорофилл, а обмен электронами между ним и триплетным кислородом приводит к появлению синглетного кислорода в возбужденном состоянии, что делает его еще более сильным окислителем. Для «гашения» триплетного хлорофилла и синглетного кислорода в состав мембран клеток растений входят каротиноиды, которые принимают в систему сопряженных связей электроны триплетного хлорофилла и синглетного кислорода и удерживают их до нового спонтанного изменения спина.
Объяснение токсичности кислорода образованием свободных радикалов впервые было дано Р. Гершман (Gershman), которая обратила внимание на подобие патологических изменений при гипероксии и рентгеновском облучении. Основываясь на том, что при радиолизе водных растворов образуются свободные радикалы, она в 1954 г. сформулировала гипотезу о том, что кислородное отравление вызывается кислородными свободными радикалами, и дала этому явлению название – гипероксидный стресс. Точно так же действие активного кислорода, каким бы ни был его источник, называют оксидативным стрессом.
Аэробные клетки подвергаются оксидативному стрессу даже при нормальном течении метаболических процессов. В клетках печени стационарная концентрация пероксида водорода определена равной 10–9 моль/л. Внутриклеточный супероксид может быть образован в результате отклонений от нормального транспорта электронов в мембране митохондрий, например, так, как это постоянно идет в эритроцитах при окислении двухвалентного железа в переносящем кислород гемоглобине (Hb), превращающегося при этом в метгемоглобин (metHb):
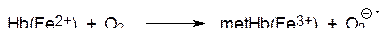
Это обеспечивает низкую, но постоянную скорость окисления некоторых железосодержащих компонент электронпереносящей цепи. Тем не менее, самую высокую склонность к одноэлектронному окислению в этой цепи показывает восстановленный убихинон или пластохинон в клетках растений.
Метаболические или экологические отклонения от нормы могут провоцировать повышенный уровень концентрации активного кислорода. При метаболических превращениях ксенобиотиков свободные радикалы образуются в качестве основного или побочного продукта. Изучение токсических характеристик четыреххлористого углерода показало, что в основе его разрушительного действия на клетки печени лежит трихлорметильный радикал (CCl3·), который образуется при метаболическом окислении четыреххлористого углерода цитохромом Р450 или гемом с Fe2+:
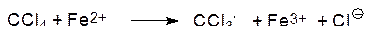
Известно также, что хиноновые соединения переводят кислород в пероксид водорода. Хорошо известному токсическому действию примахина (противомалярийного средства) на эритроциты предшествует накопление в них пероксида водорода. Флавопротеины с участием NADPH и NADH катализируют восстановление хинонов (Q) в свободнорадикальные семихиноны (HQ·), а семихиноны окисляются с образованием активного кислорода:
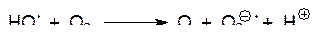
Окисление гидрохинонов (QH2) также идет с промежуточным образованием семихинонов:

Токсичность хинонов объясняется как возможностью их превращения в органические свободные радикалы, так и оксидативным стрессом в результате образования активного кислорода (возможность присоединения биомолекул по двойным связям хинонов здесь не рассматривается). Основной механизм зависит от химической природы хинона и от реакционной способности семихинонов в их реакции с кислородом. Во всяком случае, некоторые хиноидные антибиотики с противораковой активностью проявляют цитотоксичность через генерирование активного кислорода.
Активный кислород лежит в основе гербицидной активности и токсичности параквата и других дипиридилиевых солей (см. стр. 178), которые превращаются в катионоидные свободные радикалы при переносе одного электрона, катализируемом ферредоксинами и NADРН-зависимыми микросомальными флавопротеинами. Катион-радикал параквата легко переносит свой неспаренный электрон на кислород с образованием супероксида, а сам возвращается в окисленную дикатионную форму.
Стимулированные фагоцитные клетки (нейтрофилы) также генерируют значительные количества супероксида в результате переноса одного электрона на кислород, катализируемого NADРН-зависимым ферментным комплексом, локализованным в плазматической мембране этих клеток. Образующиеся при этом супероксид и пероксид, как известно, отвечают за бактерицидное действие нейтрофилов и участвуют в воспалительных процессах.
Многие ткани содержат ксантиндегидрогеназу (XD), которая катализирует превращение гипоксантина в ксантин и мочевую кислоту. Электроны этих субстратов переносятся на NADР+ с образованием NADРН. Иммуноцитохимический анализ показал, что этот фермент находится в эндотелии сосудистой системы. Когда ток оксигенированной крови в сосудах какого-либо органа блокируется (ишемическая болезнь), XD подвергается частичному протеолизу и превращается в ксантиноксидазу (ХО), после чего, несмотря на накопление субстрата, перенос электронов на NADР+ становится невозможным, так как ХО этот процесс уже не катализирует. Конечным акцептором становится кислород, и опять образуются супероксид и пероксид. Постишемический поврежденный эндотелий сосудов, омываемый оксигенированной кровью, становится источником активного кислорода и повреждается им еще больше.
Собственные защитные системы клеток, предназначенные для нейтрализации активного кислорода и включающие такие вещества, как витамин Е, аскорбиновая кислота, глютатион и другие восстановители, достаточно эффективно справляются с образованием свободных радикалов и пероксидов в отсутствии соответствующих стрессов. Однако неблагоприятные условия окружающей среды и многие токсичные соединения вызывают усиленное образование этих окислителей и тогда собственных защитных сил организма может оказаться недостаточно.
В последнее время широкое распространение в качестве пищевых добавок и лекарственных средств получили натуральные вещества, ингибирующие течение свободнорадикальных реакций и окислительных превращений в организме человека. Более всего известны в этой области такие биофлавоноиды растительного происхождения, как рутин, кверцетин, дигидрокверцетин, эриодиктиол
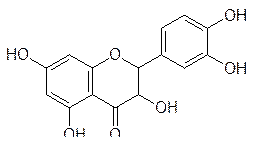
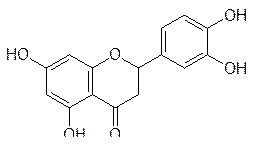
Дигидрокверцитин Эриодиктиол
В растениях эти вещества содержатся в виде гликозидов, в частности, рутин – это гликозилированный остатками глюкозы и рамнозы по гидросильной группе пиранонового цикла кверцетин. Он относится к группе витаминов Р (от англ. permeability – проницаемость). Эти вещества повышают эластичность кровеносных сосудов и снижают их проницаемость. Их рекомендуется принимать при различных заболеваниях, сопровождающихся геморрагическими состояниями. Особенно эффективен рутин в сочетании с аскорбиновой кислотой (витаминный препарат аскорутин). Вместе эти вещества принимают участие в регуляции образования белка соединительной ткани коллагена и в окислительно-восстановительных превращениях.
По биологической активности к этой же группе соединений относятся и антоциановые красители, отвечающие за окраску многих цветов и плодов (шиповник, смородина, черноплодная рябина, черника). В растениях они также находятся в виде различных гликозидов. Соответствующие агликоны называют антоцианинами. В качестве примера приводится формула цианидина:

Сравнение структур флавоноидов и антоцианинов показывает, что они способны к взаимопревращениям.
Полифенольные соединения, к которым относятся также представленные выше витамины Р и антоциановые красители, широко распространены в растительном мире. Они обладают дубящим действием, основанным на денатурации белков, и поэтому растения используют их в качестве средств защиты от травоядных животных, насекомых и патогенных грибов. Вяжущий вкус во рту предупреждает, что денатурации подвергнутся и пищеварительные ферменты, что сделает поедание растений и плодов с дубящими веществами совершенно бесполезным или даже опасным.
Еще одно полифенольное соединение – ресвератрол, или 3,5,4¢-тригидрокси- транс -стильбен, (на него обратили внимание всего лишь несколько лет тому назад) обнаружено в шкурке виноградных ягод, где он выполняет роль фитоалексина – вещества с фунгицидными свойствами, защищающего ягоды винограда от поражения плесневыми грибками:
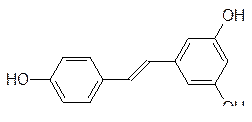
Поскольку поражение патогенными грибами протекает обычно на холоду при влажных погодных условиях, виноград, выращиваемый в регионах с более прохладным климатом, обогащен этим биологически активным веществом.
Вероятнее всего именно ресвератрол лежит в основе так называемого «французского парадокса». Он состоит в том, что, несмотря на употребление жирной мясной пищи, французы реже страдают от сердечно-сосудистых заболеваний, чем другие европейцы. Это связывают с тем, что они чаще употребляют красное вино. Дело в том, что ресвератрол плохо растворим в воде и поэтому его очень мало в виноградном соке и в белом вине, которое получают сбраживанием виноградного сока. В отличие от этого технология приготовления красного вина основана на ферментации сока вместе со шкурками и косточками, и образующийся при этом спирт улучшает растворимость ресвератрола, а вместе с ним и придающих окраску вину антоциановых красителей.
Ресвератрол содержится во многих растениях, например, в эвкалипте, ели, в плодах шелковицы, в арахисе, но больше всего его в винных сортах винограда. Исследования показали, что ресвератрол является эффективным антиоксидантом, средством для профилактики раковых заболеваний и соединением с эстрогенной активностью.
ЗАКЛЮЧЕНИЕ
Проблеме взаимодействия как новых, так и уже известных химических соединений с живой природой уделяется серьезное внимание при разработке процессов химической технологии и новых материалов самого разного назначения, поскольку это связано с безопасностью производств и выпускаемой продукции. Тем более важным представляется изучение биохимии или химии живого для исследователей, специализирующихся в области экологии, токсикологии, а также в области получения косметических средств, в области синтеза лекарственных и агрохимических препаратов. Однако овладение всем богатством знаний, накопленных за многие годы развития биохимии как самостоятельной естественнонаучной дисциплины, не представляется возможным в рамках программ подготовки специалистов по химической технологии и химии биологически активных соединений.
При изучении молекулярных механизмов взаимодействия многих токсичных соединений, агрохимических препаратов и лекарств с объектами живой природы уже получен огромный объем экспериментальных данных, основываясь на которых можно с определенной уверенностью предвидеть последствия воздействия новых химических соединений на различные биохимиические системы. Эти данные позволили также отказаться от принятого ранее «химического» подхода к классификации биологически активных соединений, когда, например, вещества с одинаковым механизмом действия, но с разной химической структурой изучались независимо друг от друга, или когда близкие по строению вещества объединялись в одну группу без учета механизмов их биологической активности.
В соответствии с этим представленный специализированный курс биохимии, предназначен в первую очередь для того, чтобы синтетики и разработчики новых химических технологий получили основы для понимания молекулярных механизмов конкуренции и взаимодействия ксенобиотиков с самыми разными составляющими живых клеток, начиная от таких сравнительно простых молекул, как метаболиты, липиды клеточных мембран, нейромедиаторы или гормоны, и кончая белками, нуклеиновыми кислотами и другими сложными биохимическими системами на основе биополимеров. В данном курсе, например, лишь затрагиваются такие современные разделы биохимии, как молекулярная биология, но в то же время в него включены такие важные для химиков вопросы, как метаболизм ксенобиотиков и взаимодействие молекул живого с активированным кислородом, а также химия фотосинтеза, часто отсутствующая в обычных учебниках по биохимии.
C
А
аллостерическими ферментами, 127
аминокислотам, 90
амфифильные молекулы, 64
анаболизм, 128
антиметаболитам, 59
антиметаболитами, 123
апоферментом, 105
аскорбиновая кислота (витамин С), 42
Б
белки, 93
бесконкуретное ингибирование, 126
бессмысленными, 52
В
вискозой, 38
вставки, 52
вторичную структуру, 94
Г
гепарин, 40
гидролазы, 104
гирудин, 41
гликозидами, 28
глюкозы, 22
Д
дезоксирибонуклеиновыми кислотами, 45
делеции, 52
денатурацией, 97
З
заменимым, 90
зрелой мРНК, 52
И
изомеразы, 104
инвариантными, 96
интеркаляторами, 61
интроны, 52, 98
К
катаболизм, 128
кодирующей, 51
кодонами, 52
конкурентного ингибирования, 123
косубстрат, 105
кофакторы, 106
коферментом, 105
крахмал, 36
Л
лактам-лактимная таутомерия, 47
Лактоза, 35
лиазы, 104
М
метаболизмом, 127
метаболиты, 128
Метаболические пути, 133
миоглобин, 94
моносахаридами, 22
мочевая кислота, 47
мутаротацией, 26
Н
незаменимыми, 90
нуклеотиды, 46
О
оксидоредуктазы, 103
олигопептидом, 93
П
первым механизмом, 133
полипептиды, 93
простаноиды, 67
простетической группой, 105
Р
регуляторные ферменты, 127
рибозимы, 53
рибозы, 22
рибонуклеаза, 97
рибонуклеиновыми кислотами, 45
С
сахарами, 22
сахароза, 35
складчатая b-структура, 94
сплайсинг, 52
Т
транслоказы, 77
транспортные РНК, 53
трансферазы, 104
третичную структуру, 94
Х
холоферментом, 106
хромосомами, 50
Ц
целлюлоза, 36
цианкобаламин, 113
цитохром с, 96
Э
экзоны, 52
эффекторами, 106
[1] Эллиот В., Эллиот Д. Биохимия и молекулярная биология. – М.: МАИК, 2003, 446 с.
 2020-10-10
2020-10-10 142
142







