Биоактивные пептиды, выполняющие роль специфических внутриклеточных реагентов (например, глутатион), нейромедиаторов или гормонов, синтезируются различными путями. Если в клетке должен поддерживаться постоянный уровень какого-либо короткоцепочечного пептида, то синтез его идет по обычной схеме ферментативного катализа путем последовательного ацилирования аминокислот с помощью универсального источника свободной химической энергии аденозинтрифосфата. Так, например, глютатион, который содержится во всех живых клетках и является носителем до 90% всех небелковых тиольных групп в клетках млекопитающих, синтезируется в две стадии. Сначала глютаминовая кислота и цистеин при катализе g-глютамилцистеинсинтетазой в присутствии АТФ реагируют с образованием g-глютамилцистеина; АТФ при этом разлагается на АДФ и фосфат:
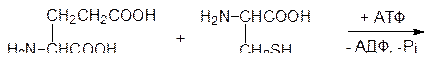
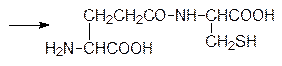
Промежуточным продуктом в этой реакции является смешанный ангидрид глютаминовой кислоты по g‑карбоксильной группе и аденозиндифосфата по концевому фосфатному остатку. На второй стадии по аналогичной схеме g‑глютамилцистеин и глицин реагируют в присутствии АТФ при катализе глутатионсинтетазой с образованием этого необычного трипептида:
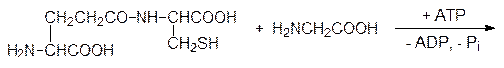
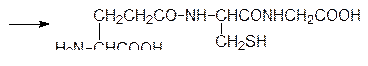
Однако чаще всего небольшие пептидные молекулы образуются путем гидролитического расщепления полипептидов или белков неизбирательными или специфическими ферментами. В качестве примера можно привести образование ангиотензина, октапептида с гормональной активностью, который участвует в регуляции кровяного давления. В печени образуется сывороточный белок ангиотензиноген, из которого под действием фермента ренина в почечной ткани образуется неактивный декапептид ангиотензин I (Асп–Арг–Вал–Тир–Иле–Гис–Про–Фен–Гис–Лей). При появлении необходимости в активном ангиотензине II с С-конца ангиотензина I ангиотензин-I-конвертирующий фермент, относящийся к гидролазам, отщепляет два аминокислотных фрагмента Гис–Лей. На блокировке этого избирательного фермента основано действие современных средств для лечения гипертонии – энапа (эналаприла), каптоприла (капотена) и др. Такой путь образования гормонов пептидной природы позволяет ЦНС быстро и эффективно регулировать их содержание в крови. Аналогично поддерживается уровень такого важного пептидного гормона, как инсулин (см. стр. 182).
Еще один пример представлен образованием тетрапептида, стимулирующего высшую нервную деятельность, из адренокортикотропного гормона (АКТГ). Аминокислотная последовательность этого секретируемого гипофизом гормона, состоящего из 39 аминокислот, включает последовательность Мет–Глу–Гис–Фен (от четвертой до седьмой аминокислоты с N‑конца). Соответствующий этой последовательности тетрапептид в незначительном количестве образуется при протеолизе АКТГ. На его основе получено одно из немногих лекарств пептидной природы с широким спектром действия – семакс (Мет–Глу–Гис–Фен–Про–Гли–Про).
Принцип последовательного соединения аминокислот в белковые молекулы, включающие чаще всего несколько сотен аминокислот, при катализе избирательными ферментами на каждой стадии невозможен, поскольку число таких ферментов превысит все разумные пределы. Это тем более очевидно, что последовательность аминокислот в белке закодирована в молекуле мРНК, согласование кодонов которой с активными центрами каждого из таких ферментов привело бы к еще большему усложнению задачи. Вот почему для синтеза белков живая природа использует уникальный механизм, реализуемый в рибосомах, состоящих из двух субъединиц, каждая из которых включает несколько десятков белков и одну или две молекулы РНК (так называемые рибосомальные РНК, рРНК); на долю рРНК в рибосомах приходится около 65% их общей массы. Для узнавания аминокислоты комплексом рибосомы и мРНК служат транспортные РНК (тРНК), к которым избирательные ферменты присоединяют соответствующие белковые аминокислоты.
Каждая молекула тРНК состоит из примерно 80 нуклеотидов, многие из которых модифицированы (чаще всего они метилированы). Спаренные основания в молекулах тРНК образуют четыре коротких спирали, три из которых заканчиваются петлями. Если молекулу тРНК расположить в плоскости, то она будет иметь форму клеверного листа, который, правда, больше похож на крест. Начало и конец линейной молекулы тРНК образуют спираль, которой противостоит спираль с петлей, включающей антикодон, предназначенный для связывания с кодоном мРНК. Концевой участок тРНК (чаще всего он состоит из четырех нуклеотидов, где три последних это –ССА) не вовлечен в образование водородных связей с начальным участком тРНК, это так называемый 3¢‑конец.
Синтез белка начинается с того, что карбоксильная группа аминокислоты ацилирует гидроксильную группы в рибозидном фрагменте тРНК с 3¢‑конца соответствующей этой аминокислоте тРНК. Активация карбоксильной группы идет по обычному механизму с участием АТФ, превращающегося при этом в АМФ и пирофосфат. Поскольку пирофосфат разлагается пирофосфатазой на две молекулы фосфата, этот процесс эквивалентен расходованию двух молей АТФ. Катализ этой реакции осуществляют аминоацил-тРНК-синтетазы, специфичные по каждой аминокислоте и по каждой соответствующей ей тРНК (для некоторых аминокислот может быть несколько тРНК). После образования аминоацилзамещенной тРНК аминокислота больше не участвует в распознавании, то есть каталитический центр рибосом, предназначенный для образования пептидных связей, неизбирателен, он универсален для всех связанных с соответствующими тРНК аминоацильных остатков.
Организующая поверхность (мРНК) и аминоацилзамещенные тРНК встречаются на рибосомах, где и идет сборка полипептидной цепи. В клетках животных основная масса рибосом связана с эндоплазматическим ретикулумом («шероховатый» ретикулум).
В синтезе белка выделяют три стадии – инициация, элонгация и терминация. Синтез белковой молекулы начинается с инициирующей тРНК, связанной с N‑формилметионином в прокариотических клетках и с метионином в эукариотических клетках. Это означает, что в эукариотических клетках кроме тРНКMet, предназначенной для введения в состав белка молекулы метионина в процессе элонгации, есть еще одна тРНКMet, принимающая участие в инициации синтеза белка.
На большой и на малой субъединицах рибосомы есть два центра связывания, обозначаемые буквами Р и А: пептидилсвязывающий центр (Р) и аминоацилсвязывающий центр (А). Для образования синтезирующего белок комплекса от рибосомы отходит малая субъединица и связывается с мРНК. Затем к комплексу мРНК и малой субъединицы рибосомы присоединяется инициирующая метионил–тРНКMet (напомним, что у прокариот это формилметионил–тРНКfMet), то есть специфичность связывания определяется антикодоном на метионил–тРНКMet и соответствием этой инициирующей аминоацилированной тРНК пептидилсвязывающему центру. После этого с участием гуанозинтрифосфата, разлагающегося при этом на гуанозиндифосфат и фосфат, происходит присоединение большой субъединицы рибосомы к комплексу, состоящему из малой субъединицы рибосомы, мРНК и инициирующей метионил–тРНКMet. В этом сложном процессе принимают участие белковые факторы инициации (IF, IF2 и IF3).
Далее идет процесс элонгации, когда к аминоацилсвязывающему центру в соответствии с кодоном на мРНК подходит другая соответствующая ему тРНК, несущая аминоацильный остаток. В этом снова участвуют вспомогательные белки, называемые факторами элонгации, а энергию для связывания снова поставляет ГТФ. В состав рибосомы входит фермент пептидилтрансфераза, в активном центре которой оказываются ацилированные аминокислотами 3¢‑концы инициирующей метионил–тРНКMet и второй тРНК. При катализе этим ферментом метионильный остаток ацилирует аминогруппу связанной с тРНК аминокислоты, в результате чего в пептидилсвязывающем центре оказывается тРНКMet со свободными гидроксильными группами в 2¢- и 3¢-положении, а в аминоацилсвязывающем центре тРНК с дипептидильным остатком, например:
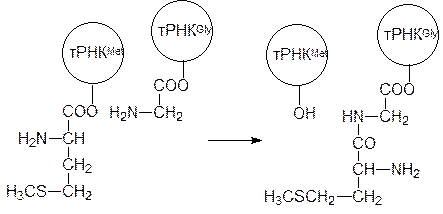
Свободная инициирующая тРНКMet покидает пептидилсвязывающий центр, и происходит одновременное смещение мРНК и тРНК с дипептидильным остатком в освободившийся пептидилсвязывающий центр. Энергию для этого снова поставляет ГТФ. В освободившемся аминоацилсвязывающем центре оказывается третий кодон мРНК, после этого сюда подходит третья мРНК с соответствующей аминокислотой, и процесс повторяется уже с переносом на аминоацильный остаток дипептидильного остатка.
Так наращивание последовательности аминокислот в белке идет до тех пор, пока в аминоацилсвязывающий центр перемещаются соответствующие кодоны мРНК. После окончания синтеза белковой молекулы к работе рибосомы подключаются факторы терминации, вызывающие гидролитическое отщепление белка (полипептида) от последней тРНК, отделение от пептидилсвязывающего центра свободной тРНК и диссоциацию рибосомы на малую и большую субъединицы для того, чтобы можно было начать новый цикл синтеза белка со стадии инициации.
Энергетическая стоимость образования одной пептидной связи на рибосоме эквивалентна расходованию четырех молекул АТФ, что значительно выше, чем при ферментативном катализе образования пептидной связи без участия РНК. Напоминаем, что при образовании аминоацилированной тРНК АТФ разлагается на АМФ и два моля фосфата, а при элонгации расходуется еще два моля ГТФ на связывание аминоацилированной тРНК и на перемещение ее из аминоацилсвязывающего центра в пептидилсвязывающий центр. Для наработки большого количества белка на одной молекуле мРНК могут одновременно вести его синтез несколько рибосом.
По мере элонгации молекулы белка идет его сворачивание в трехмерную структуру (фолдинг), но синтез молекулы начинался с метионина или, соответственно, формилметионина и далеко не все белки или полипептиды имеют его в качестве N‑концевой аминокислоты. Это означает, что после отделения от рибосомы полипептидной молекулы должен пройти гидролиз на ее N-конце с отщеплением остатка метионина (обычно отщепление затрагивает несколько аминокислотных остатков). Кроме того, синтезированные в клетке белки часто должны пройти через клеточные мембраны для того, чтобы проникнуть в какие-либо клеточные органеллы или выйти из клетки. Для этого синтезируемый рибосомой белок содержит в N‑концевой области полипептидную последовательность из 15–30 аминокислот с гидрофобными радикалами, ее называют сигнальной последовательностью. Она «протаскивает» белковую молекулу через соответствующую мембрану и после этого также отщепляется. Постсинтетическое превращение белка, включающее иногда и химическое превращение в боковых цепях аминокислот в составе полипептидной цепи, называют процессингом, он включает также повторный фолдинг трасформированной белковой молекулы.
Синтез белка нарушается многими биологически активными веществами синтетического или природного происхождения. В качестве примера можно привести антибиотик хлорамфеникол
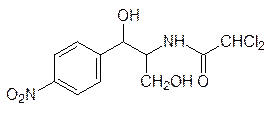
| , |
подавляющий синтез белка рибосомами прокариот и митохондрий, но не влияющий на работу внемитохондриальных рибосом эукариот.
Еще один антибиотик пуромицин
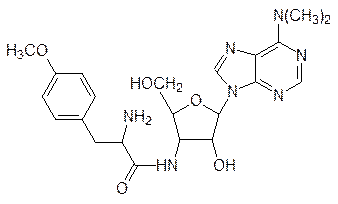
имитирует 3¢-конец фенилаланиновой или тирозиновой тРНК с соответствующей аминокислотой; его действие основано на конкурентом встраивании в активный центр пептидилтрансферазы рибосомы, где он ацилируется уже образовавшимся пептидильным остатком на тРНК. Это приводит к образованию укороченных пептидных молекул с пуромициновым фрагментом на С-конце.
 2020-10-10
2020-10-10 650
650








