Растения и микроорганизмы синтезируют все белковые (протеиногенные) аминокислоты и большое число небелковых аминокислот, участвующих в биосинтезе самых разных биогенных соединений, включая, антибиотики, токсины и другие защитные молекулы. При изучении метаболизма выше уже рассматривалось образование аминокислот из a-кетокислот в результате действия трансаминаз. Так, например, биосинтезы аланина из пирувата, а также глютаминовой кислоты, глютамина, аспарагиновой кислоты и аспарагина из кетоглутарата и, соответственно, оксалоацетата протекают по схеме, представленной на стр. 150, на примере превращения кетоглуаровой кислоты глютаминовую. Достаточно простая схема реализуется при образовании пролина из глютаминовой кислоты через ее g‑полуальдегид с циклизацией в карбоксизамещенный пирролин и с восстановлением С=N‑связи:
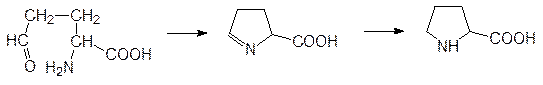
Так же легко прослеживается путь от глицеринового альдегида к серину, а глицин образуется из серина в результате отщепления концевой гидроксиметильной группы в виде формильного фрагмента под действием тетрагидрофолатзависимого фермента (см. стр. 106).
В растениях из серина образуется также цистеин в результате алкилирования сероводорода О-ацетилсерином в присутствии цистеинсинтазы:
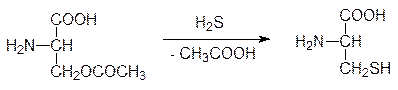
В свою очередь цистеин в растениях служит источником серы для образования метионина, а у животных источником серусодержащих соединений служит уже эта незаменимая аминокислота. Для получения сбалансированных по аминокислотному составу кормов метионин производят в промышленном масштабе по схеме:
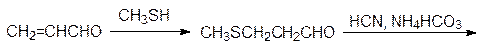
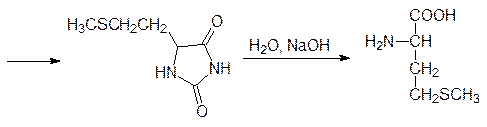
Окислением пропилена кислородом воздуха в присутствии катализатора на основе оксида ванадия получают акролеин, который присоединяет метилмеркаптан по олефиновой двойной связи с образованием b-метилмеркаптопропионового альдегида. Этот альдегид вступает в реакцию Бухерера–Бергса и превращается в 5‑(2‑метилмеркаптоэтил)гидантоин, который гидролизуется в присутствии щелочи при нагревании под давлением и превращается в D, L -метионин. Рацемический метионин можно разделить на стереоизомеры способом Гринштейна (ацетилирование по аминогруппе и ферментативный гидролиз ацетилазой, избирательно гидролизующей ацетилированный L -метионин), но для метионина эта операция не является обязательной, поскольку его D -изомер нетоксичен.
Рассмотрение синтетических путей, ведущих ко всему разнообразию протеиногенных и небелковых аминокислот, можно ограничить схематическим представлением образования в растениях фенилаланина и аминокислот с алифатическими заместителями (валина, лейцина, изолейцина), поскольку на блокировке их биосинтеза основано гербицидное действие самых распространенных средств борьбы с сорной растительностью – глифосата и сульфонилгетерилмочевин.
Образование всех ароматических соединений в растениях начинается с шикимовой кислоты, образующейся в ряде последовательных реакций из D -эритрозо-4-фосфата и фосфоенолпирувата. 5-Фосфошикимовая кислота реагирует с фосфоенолпируватом при катализе 3-еноилпирувил-5-фосфошикиматсинтазой с образованием 3‑еноилпирувил-5-фосфошикимовой кислоты:
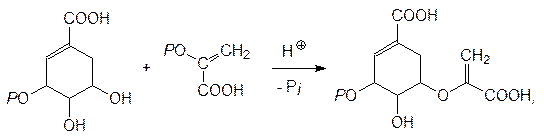
которая отщепляет фосфат и превращается в хоризмовую кислоту:
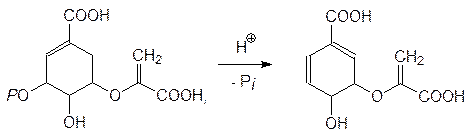
В результате внутримолекулярного алкилирования хоризмовая кислота превращается в префеновую кислоту, которая после декарбоксилирования и дегидратации превращается в фенилпировиноградную кислоту:
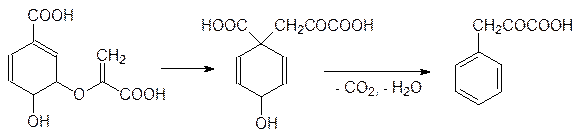
Декарбоксилирование и дегидрирование префеновой кислоты приводит к 4‑гидроксифенилпировиноградной кислоте. Затем фенилпировиноградная кислота действием трансаминаз превращается в фенилаланин, а 4‑гидроксифенилпировиноградная кислота – в тирозин. Из хоризмовой кислоты через стадию образования антраниловой кислоты в клетках растений образуется триптофан.
Взаимодействие фосфошикимовой кислоты с фосфоенолпируватом – одна из немногих биохимических реакций, где фосфоенолпируват реагирует в протонированном виде. Предполагалось, что используемый в качестве средства борьбы с сорной растительностью (гербицида) фосфонометилглицин (глифосат) является антиметаболитом протонированного фосфоенолпирувата:
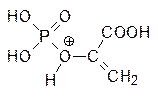
| и | 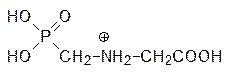
|
Однако более детальные исследования показали, что сайты связывания этих веществ различны, то есть речь идет о неконкурентном ингибировании 3‑еноилпирувил-5-фосфошикиматсинтазы фосфонометилглицином. Обработка растений этим веществом приводит к их гибели в течение нескольких часов из-за нарушения биосинтеза ароматических кислот.
Биосинтез валина основан на реакции алкилирования пирувата по карбонильному атому углерода гидроксиэтильным остатком, образующимся при декарбоксилировании другой молекулы пирувата на тиаминпирофосфате (ТРР), в активном центре ацетолактатсинтазы:
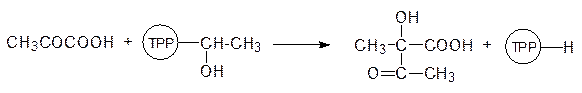
Молекула ацетолактата претерпевает внутримолекулярную перегруппировку: после протонирования атома кислорода карбонильной группы происходит миграция метильной группы в виде карбаниона на карбонильный атом углерода, а протон отходит от гидроксильной группы. Продуктом этой реакции становится 2‑кето-3-гидроксиизовалериановая кислота:
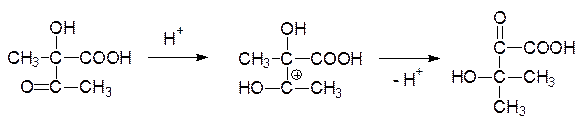
Образовавшаяся гидроксикетокислота в результате восстановления NADPH-зависимым ферментом превращается в 2,3-дигидроксиизовалериановую кислоту, которая дегидратируется и превращается в a-кетоизовалериановую кислоту. Трансаминаза переводит ее в валин:
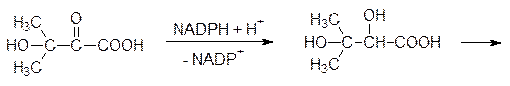
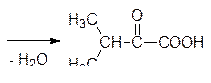
a-Кетоизовалериановая кислота является также исходным продуктом для биосинтеза лейцина. По аналогии с образованием валина, но с a-кетобутиратом, образующимся из треонина, идет биосинтез изолейцина.
Ключевой фермент в биосинтезе алифатических аминокислот – ацетолактатсинтаза – блокируется сульфонилгетерилмочевинами, например хлорсульфуроном (гербицид Глин):
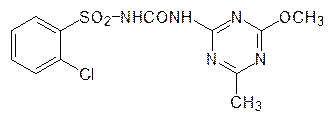
Это средство борьбы с сорной растительностью, относящееся к третьему поколению агрохимических препаратов, имеет нормы расхода около 5 г/га. Получено также большое число его структурных аналогов, которые более избирательны и более легко подвергаются метаболической деградации в растениях и в почве.
 2020-10-10
2020-10-10 170
170








