Йодбензол можно идентифицировать по температуре кипения – 188,5°С.
Глава II. Экспериментальная часть.
Синтез йодбензола
Для синтеза йодбензола выбрана четвертая методика, так как она отличается простотой выполнения эксперимента.
Необходимое оборудование: круглодонная колба на 250 мл, стакан на 100 мл – 3 шт., холодильник Либиха, шпатели – 3 шт., мерный цилиндр на 100 мл, стеклянная палочка – 1 шт., термометр на 200°С, весы технохимические, кристаллизатор со льдом, капельная воронка – 2 шт., механическая мешалка, водяная баня, обратный шариковый холодильник, универсальная индикаторная бумага, парообразователь, штатив с лапкой, алонж – 2 шт., колба коническая на 50 мл, колба Вюрца на 50 мл, воронка стеклянная – 1 шт., плитка электрическая, фильтровальная бумага – 1 шт.
Необходимые реактивы: анилин - 9,9 мл, соляная кислота (d = 1,19) - 6,8 мл, нитрит натрия – 7,7 г, йодистый калий - 29 г, серная кислота концентрированная – 11 мл, мочевина – 2 г, вода дистиллированная, гидроксид натрия 10%-ный, сульфит натрия, кальция хлорид.
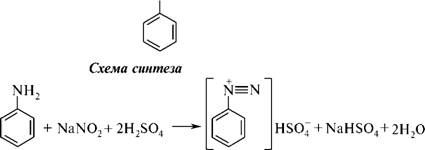
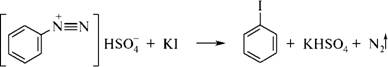
Механизм реакции:



Количественные расчеты
Расчет теоретической массы йодбензола:
m(С6H5I) -?
m(NaNO2) = 7,7 г
V(C6H5NH2) = 9,9 мл
Решение
M(NaNO2) = 69 г/моль
M(C6H5NH2) = 93 г/моль
М(С6H5I) = 204 г/моль
р(C6H5NH2) = 1,02 г/см3
m(C6H5NH2) = p ∙ V = 1,02∙9,9 = 10,098 г
n(C6H5NH2) =  =
=  = 0,11 моль
= 0,11 моль
n(NaNO2) =  = 0,11 моль
= 0,11 моль
n(C6H5N2) = 0,11 моль
n(C6H5I) = 0,11 моль
m(C6H5I) = n ∙ M = 0,11∙204 = 22,44 г
Теоретическая масса йодбензола – 22,44 г.
Ход работы
Приготовили растворы серной кислоты (11 мл концентрированной серной кислоты в 65 мл воды), йодида калия (29 г калия йодида в 35 мл воды) и нитрита натрия (7,7 г натрия нитрита в 45 мл воды) стакан, снабженный термометром и капельной воронкой, поместили 9,9 мл анилина и раствор серной кислоты. Выпал белый осадок. Смесь охладили до 0 °С в кристаллизаторе со льдом и из капельной воронки, конец которой погрузили на 1—2 см в жидкость, постепенно добавляли раствор нитрита натрия. Реакция протекала очень быстро и бурно, в результате осадок растворился и получился раствор оранжевого цвета. Диазотирование проводили при температуре не выше +5 °С. После введения раствора натрия нитрита, капельную воронку заменили механической мешалкой и реакционную смесь перемешивали в течение 1 ч. Избыток азотистой кислоты удалили добавлением ~2 г мочевины (до прекращения выделения газа).
К раствору соли диазония прилили предварительно раствор йодида калия и смесь выдерживали в течение 1 ч (избыток калия йодида препятствует образованию побочного продукта — фенола). Выделялся газ. Раствор стал маслянистым. Затем содержимое стакана перенесли в круглодонную колбу с обратным шариковым холодильником и нагревают на водяной бане до прекращения выделения азота. Раствор стал розовым. Для связывания фенола в виде натрия фенолята (натрия фенолят в отличие от фенола не перегоняется с водяным паром) смесь подщелачили 10 %-ным раствором натрия гидроксида до сильнощелочной среды по универсальной индикаторной бумаге. Раствор стал коричневым. Йодбензол отгоняли с водяным паром до тех пор, пока из холодильника не перестали стекать маслянистые желтые капли. Дистиллят перенесли в делительную воронку и отделили нижний слой йодбензола от воды в коническую колбу. Высушили хлоридом кальция.
Расчет выхода продукта:
φ = 
| Выход от теоретического значения | Выход от значения, указанного в методике |
φ =  = 0,29 = 0,29
| φ =  = 0,30 = 0,30
|
Потери вещества объясняются выплескиванием реакционной смеси на начальном этапе синтеза. Также вещество осталось на стенках посуды.
Техника безопасности при выполнении работы
1. Работа строго в вытяжном шкафу
2. Работа с растворами веществ
3. Работа с концентрированной кислотой.
Заключение
1. В ходе курсовой работы были изучены методы получения йодбензола. Существуют семь методов, с помощью которых можно осуществить этот синтез. 2. Был выполнен синтез органического соединения C6H5I с выходом продукта φ = 30%.
Список литературы
1. Хлорная кислота и ее соединения в органическом синтезе / Н.В. Дорофеенко, Ю.А. Жданов, В.И. Дуленко, С.В. Кривун - Издательство Ростовского Университета, 1965.- 256 с.
2. Практикум по органической химии: Органический синтез / С.С. Гитис, А.И. Глаз, А.В. Иванов. - М.: Высшая школа, 1991.- 326 с.
3. Реформатский С.Н. Начальный курс органической химии / С.Н. Реформатский. - М.-Л.: ГИ, 1930.- 453 с.
4. Синтезы органических препаратов. - Ч. 1. - М., 1949 стр. 220-222
5. Синтезы органических препаратов. - Ч. 3. - М., 1952 стр. 261-262
6. Органическая химия в 4 томах. Для студентов вузов по направлению и специализации / А.П. Реутов, К.П. Курц, К.П. Бутин., М.: Бином, 2004.- 645с.
7. Химический энциклопедический словарь. - М.: 1983. Т. 5.
8. Органическая химия / А.А. Петров, Х.В. Бальян, К.Г. Трощенко.- СПб.: Иван Федоров, 2005.- 565с.
 2020-10-10
2020-10-10 490
490







