1. Диссоциация: средние и двойные соли, растворимые в воде, диссоциируют полностью, у кислых и основных солей диссоциация происходит ступенчато. Растворимые соли, образованные хотя бы одним слабым электролитом, подвергаются гидролизу. Растворы таких солей могут иметь щелочную или кислую среду и взаимодействовать с индикаторами:
NaCl→ Na+ + Cl–
КNaSO4→ К+ + Na+ + SO42–
КHSO4  К+ + НSO4– HSO4–
К+ + НSO4– HSO4–  H+ + SO42–
H+ + SO42–
FeOHCl  FeOH+ + Cl– FeOH+
FeOH+ + Cl– FeOH+  Fe2+ + OH–
Fe2+ + OH–
AlCl3 + H2O  AlOHCl2 + HCl
AlOHCl2 + HCl
2. Разложение при нагревании.
Кристаллогидраты солей при нагревании теряют кристаллизационную воду:
CuSO4∙5H2O 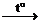 CuSO4 + 5H2O
CuSO4 + 5H2O
Гидрокарбонаты при нагревании (кальцинировании) переходят в карбонаты:
Mg(HCO3)2 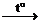 MgCO3+H2O+ СО2
MgCO3+H2O+ СО2
Карбонаты, сульфиты, сульфаты при нагревании могут разлагаться на оксид металла и кислотный оксид:
СаСO3 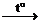 СаO + СО2
СаO + СО2
Нитраты от щелочных металлов (кроме лития) до магния и нитрат никеля (II) разлагаются при нагревании на нитрит металла и кислород:
Ni(NO3)2 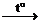 Ni(NO2)2 + O2
Ni(NO2)2 + O2
Нитраты металлов после меди (Hg(NO3)2, AgNO3) разлагаются до свободного металла, диоксида азота и кислорода:
Hg(NO3)2 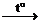 Hg+2NO2+O2
Hg+2NO2+O2
Нитраты остальных металлов (в том числе лития, магния и меди) разлагаются на оксид металла, диоксида азота и кислород:
2Cu(NO3)2 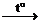 2CuO+4NO2+O2
2CuO+4NO2+O2
Нитрат и нитрит аммония:
NH4NO3 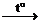 N2O+2H2O
N2O+2H2O
NH4NO2 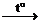 N2+ 2H2O
N2+ 2H2O
3. Взаимодействие с кислотами: если соль образована более слабой (летучей) кислотой, или в результате реакции выпадает осадок, соли вступают с кислотами в реакции обмена:
2HCl + Na2CO3 →2NaCl + CO2 + H2O
СaCl2 + H2SO4 → CaSO4 + 2HCl↑
Основные соли при действии кислот переходят в средние:
FeOHCl + HCl → FeCl2 + H2O
Средние соли, образованные многоосновными кислотами, при взаимодействии с ними образуют кислые соли:
Na2SO4 + H2SO4 → 2NaHSO4.
4. Взаимодействие со щелочами. Со щелочами реагируют соли, катионам которых соответствуют нерастворимые гидроксосоли или основания.
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
2CuSO4 + 2NaOH → (CuOH)2SO4↓ + Na2SO4
5. Взаимодействие с металлами: каждый предыдущий (более активный) металл в ряду напряжений вытесняет последующий за ним из раствора его соли:
Fe + CuSO4 → Cu↓ + FeSO4
 2020-10-10
2020-10-10 174
174








