Химическая кинетика – это учение о скорости химических реакций. Критерием принципиальной осуществимости реакций является неравенство ∆Gрт<0. Но это неравенство не является еще полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Так ∆G0298,(н2о(г)) = – 228,59 кДж/моль, а ∆G0298, (Al2O3) = – 313,8 кДж/моль и, следовательно, при температуре 289 К и давлении, равном 1,013·105 Па возможны реакции, идущие по уравнениям:
Н2(г) + ½ O2(г) = Н2О(г) (1)
2 AI(к) + 3 O2(к) = 2 AI2O3(к) (2)
Однако, эти реакции при стандартных условиях идут только в присутствии катализаторов (платины для первой и воды для второй). Катализатор как бы снимает кинетический «тормоз», и тогда проявляется термодинамическая природа вещества. Скорость химических реакций зависит от многих факторов, основные из которых – концентрация (давление – для газов) реагентов, температура и действие катализатора. Эти же факторы определяют и достижение равновесия в реагирующей системе. Зависимость скорости реакции от концентрации определяется законом действующих масс: скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Для реакции mA + nB = pC + qD скорость запишется следующим образом: υ = k ∙ C(A)m ∙ C(B)n, где k - коэффициент пропорциональности, называемый константой скорости, С – молярная концентрация, моль / л.
В гетерогенных реакциях концентрация твёрдой фазы в выражение скорости реакции не входит, т.к. твёрдые вещества реагируют с поверхности и невозможно учесть изменение её.
Обратимые химические реакции – реакции, которые при данных внешних условиях могут самопроизвольно протекать как в прямом, так и в обратном направлении. Обратимые реакции протекают до установления химического равновесия, т.е. состояния, когда скорость прямой реакции равна скорости обратной. Равновесие характеризуется константой химического равновесия К, которая показывает во сколько раз скорость прямой реакции больше скорости обратной реакции.
При увеличении температуры скорость большинства химических реакций повышается. Зависимость скорости реакции от температуры описывается правилом Вант-Гоффа: «При повышении температуры на 10 градусов скорость большинства химических реакций увеличивается в 2-4 раза».
Это правило математически выражается следующей формулой:
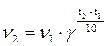 , где
, где
γ – температурный коэффициент, который показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10 градусов;
v1 – скорость реакции при температуре t1;
v2 – скорость реакции при температуре t2.
По правилу Вант-Гоффа можно рассчитывать, как изменяется скорость реакции при изменении температуры.
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе:
2 СO(г) + O2(г)  2 СO2(г)
2 СO2(г)
если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Р е ш е н и е. Обозначим концентрации реагирующих веществ:C(СO)=a, C(O2)=b, C(СO2)=c. Согласно закону действия масс, скорости прямой и обратной реакции до изменения объема Vпр =k∙а2·b; Vобр=К1·с2.
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [СO]=3а; [О2]=3b; [СO2]=3c. При новых концентрациях скорости V'пр прямой и обратной V'обр реакции:
V'пр =К (3а)2·(3b) = 27 К а2·b; V'обр =К1·(3с)2=9 К1·с2.
Отношение скоростей равно:
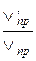 =
= 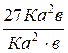 =27;
=27; 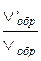 =
= 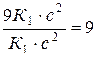 .
.
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в девять раз. Равновесие системы сместилось в сторону образования СO2.
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 300 до 70 0С, если температурный коэффициент реакции равен 2.
Р еш е н и е. Зависимость скорости химической реакции от температуры определяется правилом Вант-Гоффа:
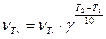
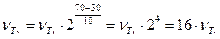 .
.
Следовательно, скорость реакции при температуре 70 0С больше скорости
реакции при температуре 30 0С в 16 раз.
Пример 3. Константа равновесия гомогенной системы:
СО(г) + Н2О (г)  СО2(г) + Н2(г)
СО2(г) + Н2(г)
при 850 0С равна 1. Вычислите концентрации всех веществ в момент равновесия, если исходные концентрации: [СО]исх=3 моль/л, [Н2О]исх =2 моль/л.
Р е ш е н и е. При равновесии скорости прямой и обратной реакции равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
Vпр=К1[СО] [Н2О]; Vобр=К2 [СО2][Н2];
Кр = 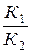 =
= 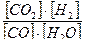 .
. 
В условии задачи даны исходные концентрации, тогда как в выражении Кр входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрации [СО2]р= х моль/л. Согласно уравнению системы, число молей образовавшегося водорода при этом будет также х моль/л. Столько же моль (х моль/л) СО и Н2О расходуется для образования по х моль СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ равны: [СО2]р=[Н2]р= х моль/л; [СО] р=(3- х) моль/л. [Н2О]р=(2- х) моль/л.
Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ:
I= 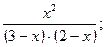
х 2 = 6 - 2 х - 3 х + х 2; 5 х = 6, х = 1,2 моль/л.
Таким образом, искомые равновесные концентрации равны:
[СО2]р=1,2 моль/л [Н2]=1,2 моль/л [СО] р=3-1,2 = 1,8 моль/л [Н2О] р=2-1,2=0,8 моль/л
Пример 4. Эндотермическая реакция разложения пентахлорида фосфора протекает по уравнению: PCI5(г) = PCI3(г) + CI2(г) ∆Н= +92,59 кДж.
Как надо изменить: а) температуру; б) давление; в) концентрацию, чтобы сместить равновесие в сторону прямой реакции?
Р е ш е н и е. Смещением или сдвигом химического равновесия называют изменение равновесных концентраций реагирующих веществ в результате изменения одного из условий реакции. Направление, в котором сместилось равновесие, определяется по принципу Ле-Шателье: а) так как реакция разложения РCI5 эндотермическая (Н>0), то для смещения равновесия в сторону прямой реакции нужно повысить температуру; б) так как в данной системе разложение РCI5 ведет к увеличению объема (из одной молекулы газа образуется две газообразные молекулы), то для смещения равновесия в сторону прямой реакции надо уменьшить давление; в) смещения равновесия в указанном направлении можно достигнуть как увеличением концентрации РCI5, так и уменьшением концентрации РCI3 или CI2.
Пример 5. Константа скорости распада пенициллина при 36 0С равна 6∙10-6с-1,
а при 41 0С - 1,2∙10-5с-1. Вычислите температурный коэффициент реакции.
Р е ш е н и е. По правилу Вант – Гоффа k2=k1 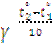 , отсюда
, отсюда 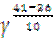 =
= 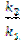 =
= 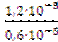 = 2;
= 2;
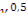 =2;
=2; 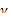 = 4. Температурный коэффициент реакции равен 4.
= 4. Температурный коэффициент реакции равен 4.
Пример 6. Константа скорости приведенной реакции при 15 0С равна 0,0454 мин-1. (CH3CO)2O(ж) + Н2О(ж) 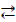 2 СН3СООН(ж)
2 СН3СООН(ж)
Исходная концентрация уксусного ангидрида равна 0,5 моль/л. Чему равна скорость прямой реакции, когда концентрация уксусной кислоты станет равной 0,1 моль/л?
Р е ш е н и е. Учитывая, что вода в избытке, кинетическое уравнение для данной реакции:
v= kc ((CН3СО)2 О)
По уравнению: 1 моль (СН3СО)2 → 2 моль СН3СООН;
По условию: 0,05 моль (СН3СО)2О ← 0,1 моль СН3СООН;
следовательно, с ((СН3СО)2О)=0,5 – 0,05 = 0,45 моль/л.
Константа скорости реакции от концентрации реагентов не зависит, поэтому
V р- ции = 0, 0454 ∙ 0,45 =0,0204 моль/л ∙ мин. Скорость реакции в момент, когда с(СН3СООН)=0,1 моль/л, составит 0,0204 моль/л ∙ мин.
209. Опираясь на знание принципа Ле-Шателье, ответьте, как повлияет на равновесную концентрацию хлора в системе:
4 HCI(г) + O2(г) 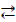 2 H2O(г) + 2 CI2 (г), ∆Hº > 0
2 H2O(г) + 2 CI2 (г), ∆Hº > 0
а) понижение давления; б) увеличение концентрации HCI; в) повышение температуры.
210. Константа скорости распада пенициллина при 36 ºС равна 6·10-6 с-1, а при 41 ºС - 1,2·10-5 с-1. Вычислите температурный коэффициент реакции. Сформулируйте правило Вант-Гоффа.
211. Энергия активации реакции кислотного гидролиза сахарозы при 37 ºС равна 102 кДж/моль, а в присутствии фермента энергия активации снижается до 35 кДж/моль. Во сколько раз быстрее протекает реакция гидролиза сахарозы в присутствии фермента?
212. Во сколько раз уменьшится скорость окисления глюкозы при гипертермии, если температура тела падает от 36,6 ºС до 27 ºС, а температурный коэффициент данной реакции равен 1,3? Что такое температурный коэффициент реакции?
213. Вычислите энергию активации реакции спиртового брожения глюкозы, если температурный коэффициент реакции в интервале температур 30 -70 ºС равен 2.
214. Окисление серы и ее диоксида протекает по уравнениям:
а) S(к) + O2(г) = SO2(г) б)2 SO2(г) + O2 = 2SO3(г)
Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза?
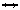 215. Напишите выражение для константы равновесия гомогенной системы N2+3H2 2NH3. Как изменится скорость прямой реакции образования аммиака, если увеличить концентрацию водорода в три раза?
215. Напишите выражение для константы равновесия гомогенной системы N2+3H2 2NH3. Как изменится скорость прямой реакции образования аммиака, если увеличить концентрацию водорода в три раза?
 216. Реакция идет по уравнению N2 + O2 2NO. Концентрации исходных веществ до начала реакции были [N2]исх. = 0,049 моль/л; [О2] = 0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NО] = 0,005 моль/л.
216. Реакция идет по уравнению N2 + O2 2NO. Концентрации исходных веществ до начала реакции были [N2]исх. = 0,049 моль/л; [О2] = 0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NО] = 0,005 моль/л.
217. Реакция идет по уравнению N2 + 3 Н2 = 2 NН3. Концентрации участвующих в ней веществ были: [N2] = 0,80 моль/л; [Н2] = 1,5 моль/л; [NН3] = 0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 0,5 моль/л.
 218. Реакция идет по уравнению Н2+J2 2HJ. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ: [Н2]исх.= 0,04 моль/л; [J2]исх.= 0,05 моль/л. Вычислите начальную скорость реакции и ее скорость, когда [Н2] = 0,03 моль/л.
218. Реакция идет по уравнению Н2+J2 2HJ. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ: [Н2]исх.= 0,04 моль/л; [J2]исх.= 0,05 моль/л. Вычислите начальную скорость реакции и ее скорость, когда [Н2] = 0,03 моль/л.
219. Вычислите во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру с 120 до 80 0С. Температурный коэффициент скорости реакции равен 3.
220. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 600С, если температурный коэффициент скорости данной реакции 2?
 221. В гомогенной системе СО + CI2 COCI2 равновесные концентрации реагирующих веществ: [CO] = 0,2 моль/л; [CI2] = 0,3 моль/л; [COCI2] = 1,2 моль/л. Вычислите константу равновесия системы и исходные концентрации Cl2 и СО.
221. В гомогенной системе СО + CI2 COCI2 равновесные концентрации реагирующих веществ: [CO] = 0,2 моль/л; [CI2] = 0,3 моль/л; [COCI2] = 1,2 моль/л. Вычислите константу равновесия системы и исходные концентрации Cl2 и СО.
 222. В гомогенной системе А+2 В С равновесные концентрации реагирующих газов: [А] = 0,06 моль/л; [В] = 0,12 моль/л; [С] = 0,216 моль/л. Вычислите константу равновесия системы и исходные концентрации веществ А и В.
222. В гомогенной системе А+2 В С равновесные концентрации реагирующих газов: [А] = 0,06 моль/л; [В] = 0,12 моль/л; [С] = 0,216 моль/л. Вычислите константу равновесия системы и исходные концентрации веществ А и В.
 223. В гомогенной газовой системе А+В С+D равновесие установилось при концентрациях: [В] = 0,05 моль/л и [С] = 0,02 моль/л. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В.
223. В гомогенной газовой системе А+В С+D равновесие установилось при концентрациях: [В] = 0,05 моль/л и [С] = 0,02 моль/л. Константа равновесия системы равна 0,04. Вычислите исходные концентрации веществ А и В.
224. Константа скорости реакции разложения N2O, протекающей по уравнению 2 N2O = 2 N2 + O2, равна 5·10-4: начальная концентрация N2O равна 6,0 моль/л. Вычислите начальную скорость реакции и ее скорость, когда разложится 50% N2O.
 225. Напишите выражение для константы равновесия гетерогенной системы СО2 + С 2 СО. Как изменится скорость прямой реакции – образования СО, если концентрация СО2 уменьшится в 4 раза? Как следует изменить давление, чтобы повысить выход СО?
225. Напишите выражение для константы равновесия гетерогенной системы СО2 + С 2 СО. Как изменится скорость прямой реакции – образования СО, если концентрация СО2 уменьшится в 4 раза? Как следует изменить давление, чтобы повысить выход СО?
 226. Напишите выражение для константы равновесия гетерогенной системы С + Н2О(г) СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водяных паров?
226. Напишите выражение для константы равновесия гетерогенной системы С + Н2О(г) СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водяных паров?
 227. Равновесие гомогенной системы: 4 НCI(г) + O2(г) 2 H2O(г) + 2 CI2(г)
227. Равновесие гомогенной системы: 4 НCI(г) + O2(г) 2 H2O(г) + 2 CI2(г)
установилось при следующих равновесных концентрациях реагирующих веществ [H2O] = 0,14 моль/л; [CI2] = 0,14 моль/л; [HCI] = 0,20 моль/л; [O2] = 0,32 моль/л. Вычислите исходные концентрации хлороводорода и кислорода.
228. Вычислите константу равновесия для гомогенной системы:
СО(г) + H2O(г) 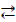 СО2(г) + H2(г),
СО2(г) + H2(г),
если равновесные концентрации реагирующих веществ: [СO] = 0,004 моль/л; [H2О] = 0,064 моль/л; [CО2] = 0,016 моль/л; [H2] = 0,016 моль/л. Чему равны исходные концентрации воды и СО?
229. Константа равновесия гомогенной системы:
 СО(г) + H2O(г) СО2(г) + H2(г)
СО(г) + H2O(г) СО2(г) + H2(г)
при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации: [СО]исх= 0,10 моль/л; [H2О]исх = 0,40 моль/л.
 230. Константа равновесия гомогенной системы N2 + 3 H2 2 NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота.
230. Константа равновесия гомогенной системы N2 + 3 H2 2 NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота.
231. При некоторой температуре равновесие гомогенной системы
 2 NО + О2 2 NО2 установилось при следующих концентрациях веществ: [NО] = 0,2 моль/л; [О2] = 0,1 моль/л; [NО2] = 0,1 моль/л. Вычислите константу равновесия и исходную концентрацию NО и О2.
2 NО + О2 2 NО2 установилось при следующих концентрациях веществ: [NО] = 0,2 моль/л; [О2] = 0,1 моль/л; [NО2] = 0,1 моль/л. Вычислите константу равновесия и исходную концентрацию NО и О2.
232. Почему при изменении давления смещается равновесие системы

 N2 + 3 Н2 NН3 и не смещается равновесие системы N2 + О2 2 NО? Ответ дайте на основании расчета скорости прямой и обратной реакции в этих системах до и после изменения давления. Напишите выражение для констант равновесия каждой из данных систем.
N2 + 3 Н2 NН3 и не смещается равновесие системы N2 + О2 2 NО? Ответ дайте на основании расчета скорости прямой и обратной реакции в этих системах до и после изменения давления. Напишите выражение для констант равновесия каждой из данных систем.
233. Исходные концентрации [NО]исх. и [CI2] исх. в гомогенной системе
 2 NО + CI 2 2 NОCI составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NО.
2 NО + CI 2 2 NОCI составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NО.
 2020-10-10
2020-10-10 732
732








