1. Молярная концентрация — отношение количества вещества В (в молях), содержащегося в растворе (р), к объему этого раствора:
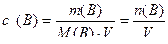 , моль/л
, моль/л
где m (В) — масса растворенного вещества В, г; M (В) — молярная масса вещества В, г/моль; V — объем раствора (в литрах).
Например, молярная концентрация раствора, в 250 мл = 0,25 л которого содержится 0,25 г серной кислоты равна:
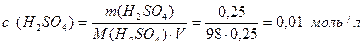
Вместо обозначения моль/л допускается обозначение М (например, 0,01 М).
2.Молярная концентрация эквивалентов — отношение количества вещества эквивалентов (в молях), содержащегося в растворе, к объему этого раствора.

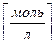
Вместо обозначения моль/л допускается сокращение н (например, 1 н).
Раствор, в 1 л которого содержится 1 моль эквивалентов вещества, называется нормальным, 0,1 моль/л – децинормальным, 0,01 моль/л - сантинормальным.
3. Массовая доля — отношение массы растворенного вещества (В) к общей массе раствора (р).
Массовую долю можно выражать в долях единицы.
 в долях единицы
в долях единицы
 в процентах
в процентах
Массу раствора можно рассчитать по формулам:
m (р) = m (растворителя) + m (вещества), m (р) = ρ∙V,
где V – объём раствора, мл или см3; ρ – плотность раствора г/мл или г/см3.
Если известны объем раствора V в мл и его плотность ρ в г/мл, то массовую долю (в %) растворенного вещества В можно рассчитать, пользуясь уравнением:
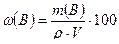 (%)
(%)
4. Моляльная концентрация — отношение количества растворенного вещества В (в молях) к массе m растворителя Y, выраженной в кг.

5. Титр — отношение массы (г) растворенноговещества В к объему раствора V (мл):
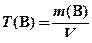
Зная титр раствора можно рассчитать молярную концентрацию раствора и молярную концентрацию эквивалентов по формулам:
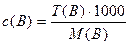 и
и
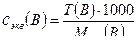
Пример 1. Вычислите: а) массовую долю вещества (ω) в процентах; б) молярную концентрацию вещества c; в) молярную концентрацию эквивалентов cэкв раствора ортофосфорной кислоты, полученного при растворении 18 г кислоты в 282 см3 воды, если плотность его 1,031 г/м3. Чему равен титр (Т)этого раствора?
Р е ш е н и е: а) Плотность воды равна 1 кг/см3, поэтому масса воды объемом 282 см3 равна 282 г, тогда масса полученного раствора 18+282 = 300г и, следовательно,
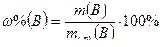
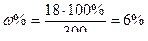
б) Находим массу 1л кислоты
m(кислоты)=ρ•V=1,031∙1000=1031г
Вычисляем массу кислоты, содержащейся в 1031г раствора кислоты:
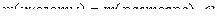
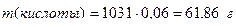
в) молярную концентрацию раствора находим делением массы кислоты, содержащейся в 1л раствора на молярную массу Н3РО4 (98 г/ моль):
с =6 1,86/98 =0,63 моль/л или 0,63 М;
в) находим молярную концентрацию эквивалентов (нормальность) ортофосфорной кислоты.
Молярная масса эквивалентов равна Мэкв(Н3РО4) = М(Н3РО4)/3= =98/3 = 32,66 г/моль, то сэкв=61,86/32,66=1,89 н или 1,89 моль/л.
г) находим титр раствора. Так как в 1л раствора содержится 61,86 г кислоты, то Т = 61,86/1000 = 0,06186 г/см3.
Пример 2. На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5 н раствора щелочи. Вычислите молярную концентрацию эквивалентов кислоты.
Ре ш е н и е. Исходя из закона эквивалентов, вещества взаимодействуют между собой в эквивалентных соотношениях.
V1×с экв1 = V2×с экв2
50 × сэкв1 = 25 ∙ 0,5, откуда сэкв1 = 25 × 0,5/50 = 0,25 н.
Пример 3. К 1 л раствора с массовой долей КОН равной 10% (плотность 1,092 г/см3) прибавили 0,5 л раствора с массовой долей КОН равной 5% (плотность 1,045 г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора.
Р еш е н и е. Находим массу 1л раствора с массовой долей КОН равной 10%: mр1(KOH)=V× r; mр1(KOH) =1000 ∙ 1,092 = 1092 г
Вычисляем массу КОН в этом растворе: m1(KOH) = mр×w; m1(KOH) = 1092  0,1 = 109,25 г.
0,1 = 109,25 г.
Масса 0,5 л с массовой долей КОН равной 5%: mр2(KOH) = 1045  500 = = 522,5г.
500 = = 522,5г.
Вычисляем массу КОН в этом растворе: m2(KOH) = mр×w; m2(KOH) = 522,5  0,05 = 26,125 г КОН.
0,05 = 26,125 г КОН.
Находим массу вещества в общем объеме полученного раствора
mобщ = 109,2 + 26,125 = 135,325 г.
Вычисляем молярную концентрацию раствора М(КОН) = 56,0 г/моль:
 или
или 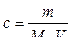
с(КОН) = 135,325/2∙56 = 1,21 моль/л.
Контрольные задания.
234. Рассчитайте молярную концентрацию раствора хлорида с массовой долей NaCl 0,9% натрия (физиологический раствор), если ρ = 1 г/см3.
235. Для обработки семян пшеницы перед посевом нужно приготовить 2000 кг раствора с массовой долей соли равной 0,2%. Определите массу соли и объем воды, которые необходимо для этого взять?
236. Рассчитайте молярную концентрацию и молярную концентрацию эквивалентов раствора борной кислоты (Н3ВО3), содержащей 5 г кислоты в 10 л раствора, применяемого для предпосевной обработки проса.
237. Рассчитайте массу раствора 1% серной кислоты, которую можно получить из 1 л 96% Н2SO4 (ρ = 1,84 г/см3) для кислования содовых солонцов?
238. Рассчитайте молярную концентрацию эквивалентов раствора безводного сульфата цинка, применяемого для внекорневой подкормки березы, если его растворимость составляет 0,5 г/л.
239. В качестве кровоостанавливающего средства применяют раствор КMnО4 с массовой долей 5%. Рассчитайте молярную концентрацию и молярную концентрацию эквивалентов. Плотность 5% раствора KMnO4 принять равной 1,05 г/см3.
240. Гидрокарбонат натрия NaНСО3 применяют для лечения ацидоза. Вычислите молярную концентрацию и молярную концентрацию эквивалентов раствора с массовой долей NaНСО3 3%, если ρ =1,01 г/см3.
241. Буру Na2В4О7 ∙ 10 Н2О применяют в качестве антисептика. Рассчитайте молярную концентрацию, молярную концентрацию эквивалентов и титр раствора, приготовленного из 10 г Na2В4О7 ∙ 10 Н2О и 90 г воды (ρ=1г/см3).
242. В медицине применяют 5-10% растворы йода для обработки ран, ссадин. Какой объем спиртового раствора йода с массовой долей 5% можно приготовить из 10 г кристаллического йода? Плотность раствора 0,950 г/см3.
243. Хлор используется для обеззараживания воды. Рассчитайте, какая масса хлора потребуется для хлорирования 500 г воды, если при хлорировании расходуется 0,002 мг хлора на 1 л воды. Объясните химико-биологическую сущность хлорирования.
244. При отравлениях ляписом желудок промывают 2%-ным раствором хлорида натрия. Рассчитайте массу NaCl, необходимую для приготовления 2 л ратвора. Плотность раствора NaCl принять равной 1,01 г/ см3.
245. На нейтрализацию 31 см3 0,16 н раствора щелочи требуется 217 см3 раствора H2SO4. Чему равны молярная концентрация эквивалентов и титр раствора H2SO4?
246. Какой объем 0,3 н раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3 раствора?
247. На нейтрализацию 1л раствора, содержащего 1,4 г КОН, требуется 50 см3 раствора кислоты. Вычислите молярную концентрацию эквивалентов кислоты в растворе.
248. Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н раствора NaOH? Каков титр раствора NaOH?
249. Какую массу нужно растворить в 400 г воды чтобы приготовить раствор с массовой долей NaNO3, равной 20%?
250. Смешали 247 г раствора с массовой долей серной кислоты 62% и 145 г раствора с массовой долей серной кислоты 18%. Какова массовая доля (%) H2SO4 в полученном растворе?
251. Из 700 г раствора с массовой долей серной кислоты 60% выпариванием удалили 200 г воды. Чему равна массовая доля (%) H2SO4 в оставшемся растворе?
252. Из 10 кг раствора с массовой долей 20% при охлаждении выделилось 40 г соли. Чему равна массовая доля соли в охлажденном растворе?
253. Вычислите массу BaCl2 ∙ 2 H2O, необходимую для приготовления 500 г раствора с массовой долей BaCl2 5%.
254. Вычислите объем раствора гидроксида натрия ρ=1,41 г/см3 (38%), необходимый для приготовления 2 кг моющего раствора с массовой долей NaOH 10%.
255. Вычислите массу K2CO3, необходимую для приготовления 100 мл 0,1 М раствора.
256. Вычислите массу BaCl2∙2H2O, необходимую для приготовления 500 мл 0,1 н раствора.
257. Какой объем раствора гидроксида натрия ρ=1,41 г/см3 (38%) и воды потребуется для приготовления 4 кг моющего раствора с массовой долей NaOH, равной 5%.
258. Вычислите массу MgSO4, необходимую для получения 0,5 кг раствора с массовой долей MgSO4 10%.
 2020-10-10
2020-10-10 499
499








