| Вещество | Состояние | S0298 Дж/моль·К | Вещество | Состояние | S0298 Дж/(моль•К) |
| С | Алмаз | 2,44 | H2O | г | 188,72 |
| С | Графит | 5,69 | N2 | г | 191,49 |
| Fe | к | 27,2 | NH3 | г | 192,50 |
| Ti | к | 30,7 | CO | г | 197,91 |
| S | Ромб. | 31,9 | C2H2 | г | 200,82 |
| TiO2 | к | 50,3 | O2 | г | 205,03 |
| FeO | к | 54,0 | H2S | г | 205,64 |
| H2O | ж | 69,94 | NO | г | 210,20 |
| Fe2O3 | к | 89,96 | CO2 | г | 213,65 |
| NH4CI | к | 94,5 | C2H4 | г | 219,45 |
| CH3ОH | г | 126,8 | CI2 | г | 222,95 |
| H2 | г | 130,59 | NO2 | г | 240,46 |
| Fe3O4 | к | 146,4 | PCI3 | г | 311,66 |
| CH4 | г | 186,19 | PCI5 | г | 352,71 |
| HCI | г | 186,68 |
ПРИМЕР 3. На основании стандартных теплот образования (табл. 9) и абсолютных стандартных энтропий веществ (табл. 11) вычислите 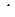 G0298 реакции, протекающей по уравнению:
G0298 реакции, протекающей по уравнению:
СО(г) + Н2О(ж) = СО2(г) + Н2(г)
Р е ш е н и е. 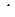 G0=
G0=  Н0-Т
Н0-Т 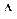 S0;
S0; 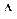 Н и
Н и 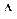 S – функции состояния, поэтому:
S – функции состояния, поэтому:
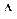 Н0х р. =
Н0х р. = 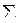
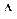 Н0прод -
Н0прод - 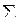
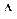 Н0исх;
Н0исх;
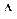 S0 х р. =
S0 х р. = 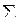 S0прод –
S0прод – 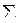 S0исх.
S0исх.
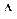 Н0х р. = (-393,51+0)-(-110,52-285,84) = +2,85 кДж;
Н0х р. = (-393,51+0)-(-110,52-285,84) = +2,85 кДж;
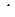 S0х р. = (213,65+130,59) – (197,91+69,94) = +76,39=0,07639 кДж / моль·К;
S0х р. = (213,65+130,59) – (197,91+69,94) = +76,39=0,07639 кДж / моль·К;
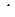 G0 = +2,85 – 2980,07639 = - 19,91 кДж.
G0 = +2,85 – 2980,07639 = - 19,91 кДж.
ПРИМЕР 4. Реакция восстановления Fe2O3 водородом протекает по уравнению Fe2O3(к) + 3 Н2(г) = 2 Fe(к) + 3 Н2О(г); 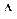 Н = + 96,61 кДж.
Н = + 96,61 кДж.
Возможна ли эта реакция при стандартных условиях, если изменение энтропии 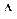 S = 0,1387 кДж / моль·К? При какой температуре начнется восстановление Fe2O3?
S = 0,1387 кДж / моль·К? При какой температуре начнется восстановление Fe2O3?
Р е ш е н и е. Вычисляем 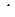 G0 реакции:
G0 реакции:
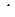 G0 =
G0 =  Н0 - Т
Н0 - Т 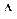 S0 = 96,61 - 298·0,1387 = +55,28 кДж.
S0 = 96,61 - 298·0,1387 = +55,28 кДж.
Так как 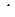 G >0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой
G >0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой 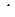 G0 = 0.
G0 = 0.
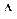 Н0 = Т
Н0 = Т 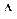 S0; Т =
S0; Т = 
Следовательно, при температуре 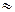 696,5 0К начинается реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
696,5 0К начинается реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
ПРИМЕР 5. Вычислите 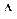 Н0,
Н0, 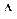 S0 реакции, протекающей по уравнению Fe2O3(к) + 3 С(к) = 2 Fe(к) + 3 СО(г). Возможна ли реакция восстановления Fe2O3 углеродом при температуре 5000 или 10000 К?
S0 реакции, протекающей по уравнению Fe2O3(к) + 3 С(к) = 2 Fe(к) + 3 СО(г). Возможна ли реакция восстановления Fe2O3 углеродом при температуре 5000 или 10000 К?
Р е ш е н и е.
 Н0х. р. = [3(-110,52)+2·0]-[-882,10+3·0] = -331,56 - 882,10 = +490,54 кДж;
Н0х. р. = [3(-110,52)+2·0]-[-882,10+3·0] = -331,56 - 882,10 = +490,54 кДж;
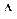 S0х. р. = (27,2 + 3·197,91) - (89,96 + 3·5,69)= 541,1 Дж/К.
S0х. р. = (27,2 + 3·197,91) - (89,96 + 3·5,69)= 541,1 Дж/К.
Энергию Гиббса при соответствующих температурах находим из соотношения
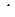 G0т =
G0т =  Н0 – Т
Н0 – Т  S:
S:
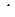 G500=490,54 - 500
G500=490,54 - 500  = + 219,99 кДж;
= + 219,99 кДж;
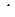 G1000=490,54 – 1000
G1000=490,54 – 1000  = - 50,56 кДж.
= - 50,56 кДж.
Так как 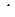 G500>0, а
G500>0, а 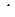 G1000 <0, то восстановление Fe2O3 углеродом возможно при 1000 0К и невозможно при 500 0К.
G1000 <0, то восстановление Fe2O3 углеродом возможно при 1000 0К и невозможно при 500 0К.
Контрольные задания
181. Вычислите 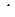 G0298 для следующих реакций:
G0298 для следующих реакций:
а) 2 NaF(к) + CI2(г) = 2 NaCI(к) + F2(г)
б) PbO2(к) + 2 Zn(к) = Pb(к) + 2 ZnO(к)
Можно ли получить фтор по реакции (а) и восстановить PbO2 цинком по реакции (б)?
182. При какой температуре наступит равновесие системы:
 4 НCI(г) + О2(г) 2 Н2О(г) + 2 СI2(г);
4 НCI(г) + О2(г) 2 Н2О(г) + 2 СI2(г); 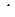 Н = - 114,42 кДж?
Н = - 114,42 кДж?
183. Восстановление Fe3O4 оксидом углерода (II) идет по уравнению:
Fe3O4(к) + СО(г) = 3 FeО(к) + СО2(г)
Вычислите 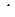 G0298 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно
G0298 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно 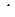 S0298 в этом процессе?
S0298 в этом процессе?
184. Реакция горения ацетилена идет по уравнению:
С2Н2(г) + 5/2 О2(г) = 2 СО2(г) + Н2О(ж)
Вычислите ∆G0298 и ∆S0298. Объясните уменьшение энтропии в результате этой реакции.
185. Уменьшается или увеличивается энтропия при переходах: а) воды в пар; б) графита в алмаз? Почему? Вычислите ∆S0298 для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях.
186. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция: Н2(г) + СО2(г) = СО(г) + Н2О(ж); ∆Н = - 2,85 кДж? Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите ∆G0298 этой реакции.
187. При какой температуре наступит равновесие системы:
СН4(г) + СО2(г) = 2 СО(г)+2 Н2(г); ∆Н = 247,37 кДж?
188. Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите ∆G0298 реакции, протекающей по уравнению: NH3(г) + HCI(г) = NH4CI(к). Может ли эта реакция при стандартных условиях идти самопроизвольно?
189. При какой температуре наступит равновесие системы:
 СО(г)+2 Н2(г) СН3ОН(ж); ∆Н = -128,05 кДж?
СО(г)+2 Н2(г) СН3ОН(ж); ∆Н = -128,05 кДж?
190. Какая - прямая или обратная реакция будет протекать при стандартных условиях в системе:
 2 NO(г) + O2 (г) 2 NO2(г)
2 NO(г) + O2 (г) 2 NO2(г)
Ответ мотивируйте, вычислив ∆G0298 прямой реакции.
191. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите значение ∆G0298 реакции, протекающей по уравнению: 4 NH3(г) + 5 O2(г) = 4 NO(г) + 6H2O(г). Возможна ли эта реакция при стандартных условиях?
192. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите ∆G0298 реакции, протекающей по уравнению СО2(г) + 4 Н2(г) = СН4(г) + 2 Н2О(ж). Возможна ли эта реакция при стандартных условиях?
193. Вычислите  Н0,
Н0,  S0, и ∆G0 реакции, протекающей по уравнению: Fe2O3(к) + 3 Н2(г) = 2 Fe(к)+3 Н2О(г). Возможна ли реакция восстановления Fe2O3 водородом при температурах 500 и 2000 К?
S0, и ∆G0 реакции, протекающей по уравнению: Fe2O3(к) + 3 Н2(г) = 2 Fe(к)+3 Н2О(г). Возможна ли реакция восстановления Fe2O3 водородом при температурах 500 и 2000 К?
194. Какие из карбонатов: ВеСО3 или ВаСО3 можно получить по реакции взаимодействия соответствующих оксидов с СО2? Какая реакция идет наиболее энергично? Вывод сделайте, вычислив ∆G0298 реакции.
195. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите  G0298 реакции, протекающей по уравнению: СО(г)+3 Н2(г) = СН4(г) + Н2О(г). Возможна ли эта реакция при стандартных условиях?
G0298 реакции, протекающей по уравнению: СО(г)+3 Н2(г) = СН4(г) + Н2О(г). Возможна ли эта реакция при стандартных условиях?
196. Вычислите  Н0,
Н0,  S0, и ∆G0 реакции, протекающей по уравнению:
S0, и ∆G0 реакции, протекающей по уравнению:
TiO2(к) + 2 C(к) = Ti(к) + 2CO(г)
Возможна ли реакция восстановления TiO2 углеродом при температурах 1000 и 3000 К?
197. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите ∆G0298 реакции, протекающей по уравнению
С2Н4(г) + 3 О2(г) = 2 СО2(г) + 2 Н2О(ж)
Возможна ли эта реакция при стандартных условиях?
198. Определите, при какой температуре начнется реакция восстановления Fe3O4, протекающая по уравнению:
Fe3O4(к) + СО(г) = 3 FeО(к) + СО2(г);  Н = 34,55 кДж
Н = 34,55 кДж
199. Вычислите, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по уравнению:
РСI5(г) = PCI3(г) + CI2(г);  Н = +92,59 кДж.
Н = +92,59 кДж.
200. Вычислите изменение энтропии для реакций, протекающих по уравнениям: 2 CH4(г) = C2H2(г) + 3 H2(г)
N2(г) + 3 H2(г) = 2 NH3(г)
C (графит) + O2(г) = CO2(г)
В каких случаях воможно протекание прямой реакции?
201. В организме человека этанол окисляется в две стадии: до уксусного альдегида (∆ H º = -256 кДж/моль), а затем до уксусной кислоты (∆ H º = -237 кДж/моль). На основании закона Гесса рассчитайте энтальпию окисления этанола до уксусной кислоты. Сформулируйте закон Гесса.
202. Стандартная энтальпия растворения сульфата меди равна – 66,5 кДж/моль; стандартная энтальпия гидратации до пентагидрата равна - 78,22 кДж/моль. Вычислите стандартную энтальпию растворения пентагидрата. Что называют энтальпией растворения?
203. Рассчитайте тепловой эффект реакции спиртового брожения глюкозы:
C6H12O6 → 2 C2H5OH + 2 CO2, используя стандартные энтальпии сгорания.
204. Используя стандартные энтальпии образования вычислите, сколько теплоты выделится при разложении 54 г глюкозы по реакции:
C6H12O6(к) → 2 C2H5OH(ж) + 2 CO2(г).
205. Среднесуточная потребность в белках, жирах и углеводах у студентов составляет соответственно: 113, 106 и 415 г. Найдите суточную потребность в энергии у студентов.
206. Определите калорийность 350 г пищевого продукта, содержащего 50% воды; 30% белка, 15% жиров, 5% углеводов. Что такое калорийность?
207. Рассчитайте массу углеводов, необходимую для восполнения энергии, затраченной при выделении 800 г воды через кожу, если для испарения 1 моль воды требуется 40,7 кДж.

 208. Вычислите энергию Гиббса реакции гидролиза АТФ до АДФ и неорганического фосфата: АТФ + Н2О АДФ + Н3РО4 в условиях, характерных для мышечной клетки, находящейся в состоянии покоя: [АТФ] = 0,005 моль/л; [АДФ] = 0,0005 моль/л; [Н3РО4] = 0,005моль/л, t = 37ºС. Константа реакции гидролиза при указанной температуре равна 8,92·104. Оцените результат.
208. Вычислите энергию Гиббса реакции гидролиза АТФ до АДФ и неорганического фосфата: АТФ + Н2О АДФ + Н3РО4 в условиях, характерных для мышечной клетки, находящейся в состоянии покоя: [АТФ] = 0,005 моль/л; [АДФ] = 0,0005 моль/л; [Н3РО4] = 0,005моль/л, t = 37ºС. Константа реакции гидролиза при указанной температуре равна 8,92·104. Оцените результат.
 2020-10-10
2020-10-10 359
359








