Вода - слабый амфотерный электролит. Молекулы воды могут как отдавать, так и присоединять катионы водорода Н+. В результате взаимодействия между молекулами в воде всегда присутствуют гидроксид-ионы ОН- и катионы водорода Н+ :
 2 H2O H3O++ OH-
2 H2O H3O++ OH-
 или H2O H++ OH-
или H2O H++ OH-
Количественно диссоциация воды описывается константой диссоциации:

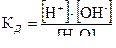 =1,86·10 -16 (22 0С)
=1,86·10 -16 (22 0С)
и ионным произведением воды
Кд • [H2O]= Кw=[H+] • [ OH-].
Молярная концентрация воды равна [H2O] равна: 1000:18=55,56 моль/л, Подставив это значение, получим:
Кw= [ H+] • [ OH-] = 1,86 10 -16 • 55,56 = 10-14
Произведение концентраций ионов водорода на концентрацию гидроксид - ионов называется ионным произведением воды (Кw). Ионное произведение воды есть величина постоянная при постоянной температуре:
[ H+]• [ОH-] = 10-14 ( при температуре 22 0).
Среда раствора
От количественного соотношения концентраций катионов водорода (протонов) H+ и гидроксид-анионов ОН- зависит среда раствора.
Для водных растворов существуют три типа среды:
1) нейтральная среда: [Н+] = [ОН-] = 10-7  моль/л;
моль/л;
2) кислая среда:: [Н+] > [ОН-]  [Н+] > 10-7 моль/л;
[Н+] > 10-7 моль/л;
3 ) щелочная среда:: [Н+] < [ОН-]  [Н+] < 10-7 моль/л.
[Н+] < 10-7 моль/л.
Водородный показатель
Водородный показатель pH - отрицательный десятичный логарифм концентрации (активности) катионов водорода в растворе:
рН = - lg[H+]
Концентрацию [ОН-] также можно выразить через гидроксидный показатель - pOH:
рОН = - lg[ОH-]
Если прологарифмировать уравнение ионного произведения воды, то получим: pH + pOH = 14
В нейтральных растворах рН = 7.
В кислых растворах рН < 7.
В щелочных растворах рН > 7.
Пример 1. Вычислить рН раствора хлороводородной кислоты с молярной концентрацией 0,001 моль/л.
Решение. НСI – это сильная кислота, в водном растворе она полностью диссоциирует на ионы:
НСI = Н+ + СI-
поэтому концентрация катионов водорода в растворе сильной кислоты равна концентрации этой кислоты:
[H+] = С (НСI); [H+] = 0,001 = 10-3 моль/л.
Рассчитаем рН: рН = - lg[H+] = - lg10-3 = 3.
Пример 2. Вычислить рН раствора гидроксида натрия с молярной концентрацией 0,001 моль/л.
Решение. КОН - это сильное основание, в водном растворе полностью диссоциирует на ионы:
КОН = К+ + ОН-
поэтому концентрация гидроксид-ионов в растворе сильного основания равна концентрации этого основания:
[ОН-] = С(КОН); [ОН-] = 0,001 = 10-3
pOH = - lg [OH-]= - lg 10-3 = 3
так как pH + pOH = 14, то рН = 14 – рОН; рН = 14 – 3 = 11.
Индикаторы
Для приблизительного определения рН служат кислотно-основные индикаторы.
 2020-10-10
2020-10-10 219
219








