(Al2S3, (NH4)2CO3, NH4CH3COO и др).
Соли, образованные сильным основанием и сильной кислотой (например, NaCI, Ba(NO3)2 и др.), а также соли, не растворимые в воде (например, CaCO3, CuS и др.), гидролизу не подвергаются.
Пример 1. Гидролиз солей, образованных слабой кислотой и сильным основанием протекает по аниону. Рассмотрим пример гидролиза одной из таких солей. KCN - эта соль образована сильным основанием КОН и слабой одноосновной циановодородной кислотой HCN. Поэтому взаимодействовать с водой, а именно с Н+ будет анион кислотного остатка соли:
CN- + НОН  HCN + ОН-
HCN + ОН-
Образующиеся в результате гидролиза ионы ОН- обеспечивают щелочную среду рН>7. Запишем полное ионно-молекулярное уравнение, добавив слева и справа ион К+
K+ + CN- + HOH  HCN + OH- + K+
HCN + OH- + K+
Молекулярное уравнение гидролиза:
KCN + НОН  HCN + КОН
HCN + КОН
Гидролиз солей, образованных слабыми многоосновными кислотами и сильными основаниями, протекает ступенчато (соответственно обратному процессу – ступенчатой диссоциации), и при этом получаются кислые соли (точнее, анионы кислых солей). Так, гидролиз карбоната калия К2CO3 может быть выражен уравнениями:
1-я ступень: СО3-2 + НОН  НСО3- + ОН-
НСО3- + ОН-
2К+ + СО3-2 + НОН  НСО3- + ОН- + 2К+
НСО3- + ОН- + 2К+
К2СО3+НОН  КНСО3+КОН среда щелочная, рН> 7
КНСО3+КОН среда щелочная, рН> 7
2-я ступень:
НСО3- + НОН  Н2СО3 + ОН-
Н2СО3 + ОН-
НСО3- + К+ + НОН  Н 2СО3 + ОН- + К+
Н 2СО3 + ОН- + К+
КНСО3 + НОН  Н 2СО3 + КОН среда щелочная, рН > 7
Н 2СО3 + КОН среда щелочная, рН > 7
Однако в обычных условиях гидролиз практически ограничивается первой ступенью: ионы СО32- связывают ионы Н+ воды, образуя сначала ионы НСО3-, а не молекулы Н2СО3. Это объясняется тем, что ионы НСО3- диссоциируют гораздо труднее, чем молекула Н2СО3. И лишь при сильном разбавлении и нагревании следует учитывать гидролиз образовавшейся кислой соли.
Среда раствора соли К2СО3 щелочная (рН>7), потому что в растворе увеличивается концентрация ионов ОН-.
Пример 2. Гидролиз солей образованных слабым основанием и сильной кислотой -гидролиз по катиону, при этом среда раствора кислая (рН < 7).
Рассмотрим гидролиз на примере нитрата аммония. Соль NH4NO3 образована слабым основанием NH4OH и сильной кислотой НNO3. Поэтому взаимодействовать с водой, а именно с ОН- будет катион NH4+ соли по уравнению:
NH4+ + НОН  NH4OH + H+ pH<7
NH4OH + H+ pH<7
Образующиеся в результате гидролиза ионы Н+ обеспечивают кислую среду раствора, рН<7.
Полное ионно-молекулярное уравнение гидролиза имеет вид:
NH4+ + NO3- +HOH  NH4OH + H+ + NO3-
NH4OH + H+ + NO3-
Молекулярное уравнение: NH4NO3 + HOH  NН4ОН + HNO3
NН4ОН + HNO3
В случае многозарядного катиона, гидролиз идет ступенчато. Число ступеней гидролиза соли зависит от кислотности слабого основания. В водных растворах таких солей по первой ступени образуется основная соль вместо основания и сильная кислота.
Рассмотрим этот случай на примере гидролиза соли хлорида магния MgCl2.
Соль MgCl2 образована слабым основанием Mg(ОН)2 и сильной кислотой НС1, поэтому взаимодействовать с Н2О будет катион Mg2+. Mg(ОН)2 – двухкислотное основание, поэтому гидролиз протекает по двум ступеням:
1 ступень: Mg2+ + HOH  MgOH+ + H+
MgOH+ + H+
2Cl- + Mg2+ + HOH  MgOH+ + H+ + 2Cl-
MgOH+ + H+ + 2Cl-
MgCl 2 + HOH  MgOHCl + HCl pH<7
MgOHCl + HCl pH<7
Продуктами первой ступени гидролиза MgCl 2 являются основная соль MgOHCl и сильная кислота HCl.
2 ступень:MgOH++HOH  Mg(OH)2 + H+
Mg(OH)2 + H+
MgOH++Cl- + HOH  Mg(OH)2 + H++Cl-
Mg(OH)2 + H++Cl-
MgOHCl + HOH  Mg(OH)2 + HCl рН<7
Mg(OH)2 + HCl рН<7
Пролуктами второй ступени гидролиза MgCl 2 являются слабое основание гидроксид магния и сильная хлороводородная кислота. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора MgCl 2 кислая (рН<7), потому что в растворе увеличивается концентрация Н+.
Пример 3. Гидролиз солей, образованных слабой кислотой и слабым основанием (гидролиз по катиону и аниону). Примерами солей этого типа являются NH4CN, Сu(СН3СОО)2, Mg(NO2)2, А12S3, Сг2(СО3)3 и т.д.
Гидролиз в данном случае идет и по катиону и по аниону одновременно. Соль NH4CN образована слабой кислотой HCN и слабым основанием NH4ОН. Поэтому с водой взаимодействуют и катионы NH4+ и анионы CN-:
NH4+ + CN- + НОН  HCN + NH4ОН
HCN + NH4ОН
NH4CN + НОН  HCN + NH4ОН
HCN + NH4ОН
В этом случае нельзя по ионному уравнению сразу определить среду раствора, но можно определить с помощью индикаторов или рН-метров, а также можно сравнить степени диссоциации (константы диссоцииации) продуктов гидролиза.
Пример 4. Необратимый гидролиз. Соли, образованные слабыми многокислотными нерастворимыми основаниями и слабыми многоосновными летучими кислототами (Al2S3, Al2(CO3), Fe2S3 и др.) гидролизуются полностью, т.е. процесс гидролиза идёт до конца необратимо сразу в одну ступень, с образованием соответствующих оснований и кислот:
Al2S3 + 6HOH = 2Al(OH)3 ↓+ 3H2S↑
2Al3+ +2S2- = 2Al(OH)3↓ + 3 H2S↑
В таблице растворимости против таких солей стоит прочерк, эти соли в водном растворе не могут существовать.
Степень гидролиза
Количественно процесс гидролиза характеризуется степенью гидролиза - отношение концентрации молекул, подвергшихся гидролизу, к общей концентрации растворенных молекул.
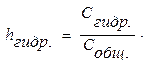
Степень гидролиза зависит:
1. От природы соли. Чем слабее основание или слабее кислота, образующие соли, тем выше степень гидролиза;
2. От концентрации раствора соли. Чем меньше концентрация вещества, тем выше степень его гидролиза;
3. От температуры. С повышением температуры гидролиз усиливается.
 2020-10-10
2020-10-10 228
228








