Буферные растворы – это растворы, сохраняющие определенную концентрацию ионов водорода (рН) при разбавлении, концентрировании и незначительно изменяющие её при добавлении небольших количеств сильных кислот или оснований. Свойство растворов сохранять определенное значение рН называется буферным действием.
Буферные растворы могут состоять из слабой кислотыи ее гидролитически щелочной соли или слабого основания и гидролитически кислой соли этого основания. Буферными свойствами обладают также растворы, содержащие смеси солей слабых многоосновных кислот.
В качестве примеров можно привести следующие буферные смеси:
СН3СООН + СН3СООNа — ацетатный буфер;
Н2СОз + NаНСОз — бикарбонатный буфер;
NH4OH + NH4CI — аммиачный буфер;
NaH2PO4 + Na2HPO4 — фосфатный буфер.
Каждая из буферных смесей характеризуется определенной концентрацией водородных ионов, которую буферная система стремится сохранять при добавлении к ней кислоты или щелочи.
Для буферной смеси, образованной слабой кислотой и ее гидролитически щелочной солью рН равен:
рН = рКк – lg 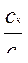
где рКк – показатель константы кислотности слабой одноосновной кислоты (отрицательный десятичный логарифм константы диссоциации слабой кислоты); ск и сс - исходные концентрации кислоты и ее соли.
Для буферной смеси, содержащей слабое однокислотное основание и его соль можно прийти к формулам:
рОН = рКо - lg 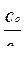 или рН = 14 – рКо + lg
или рН = 14 – рКо + lg 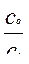
где рКо – показатель константы основности слабого однокислотного основания; со и сс – исходные концентрации слабого основания и его соли.
Способность буферных растворов поддерживать практически постоянный рН основана на том, что отдельные компоненты буферного раствора связывают Н+ или ОН-- ионы кислот или оснований, вводимых в раствор. Эта способность не безгранична, предел её зависит от концентраций компонентов буферной смеси.
Буферной емкостью (β) называется количество моль эквивалентов сильной кислоты или сильного основания, прибавление которого к 1 л буферного раствора изменяет рН этого раствора на единицу.
Для буферной системы, состоящей из раствора слабой кислоты и ее соли, буферную емкость можно приближенно рассчитать по формуле (если раствор не очень сильно разбавлен):
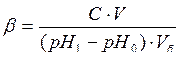

где с – концентрация сильной кислоты или основания, моль/л;
V – объем добавленной кислоты или основания, л;
Vб – объем буферного раствора, л;
рН0 и рН1 – водородные показатели до и после добавления сильной кислоты или основания.
Буферные смеси играют большую роль в регулировании жизнедеятельности организмов, в которых должно сохраняться постоянство рН крови, лимфы и других жидкостей.
Пример 1. Рассчитайте рН буферного раствора, содержащего 0,1 моль NH4OH и 0,1 моль NH4CI. Как измениться рН: а) при добавлении к 1 л раствора 0,01 моль НСI; б) при добавлении 0,01 моль NаОН; в) при разбавлении раствора водой в 10 раз? Константа диссоциации гидроксида аммония Кк = 1,79∙10-5, рКо = 4,75.
Р е ш е н и е. Для аммиачной буферной системы
рН = 14 – рКо + lg 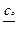
находим значение рН: рН = 14 – 4,75 + lg 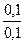 = 9,25
= 9,25
При добавлении 0,01 моль НСI концентрация гидроксида аммония уменьшается до 0,09 моль, а концентрация хлорида аммония возрастает до 0,11моль.
Находим величину рН: рН = 14 – 4,75 + lg 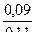 = 9,15
= 9,15
При добавлении к 1 л раствора 0,01 моль NаОН равное количество молей NH4CI превратиться в NH4OH, тогда получим:
рН = 14 – 4,75 + lg 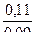 = 9,33
= 9,33
При разбавлении раствора в 10 раз имеем:
рН = 14 – 4,75 + lg 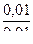 = 9,25.
= 9,25.
285-309. Определите силу осования и кислоты, образующих соль. Напишите уравнение диссоциации соли. Составьте сокращенные, полные ионно-молекулярные и молекулярные уравнения гидролиза приведенных в вашем задании солей. Укажите реакцию среды в растворе соли. Напишите выражения для константы гидролиза.
285. Хлорид магния, сульфит натрия.
286. Нитрат меди (II), карбонат калия.
287. Сульфат алюминия, силикат натрия.
288. Хлорид железа (III), сульфид натрия.
289. Сульфат аммония, цианид калия.
290. Хлорид аммония, сульфид бария.
291. Сульфат марганца (II), карбонат калия.
292. Нитрат алюминия, ацетат натрия.
293. Хлорид цинка, силикат калия.
294. Сульфат железа (II), фосфат калия.
295. Хлорид аммония, цианид натрия.
296. Хлорид цинка, карбонат натрия.
297.Ацетат калия, сульфид аммония.
298. Сульфат кадмия, хлорид меди (II).
299. Нитрит калия, сульфат аммония.
300. Бромид меди (II), ацетат калия.
301. Цианид калия, сульфат железа (II).
302. Силикат натрия, нитрат аммония.
303. Сульфид алюминия, нитрат магния.
304. Ацетат аммония, перхлорат хрома (III).
305. Хлорид алюминия, сульфат аммония.
306. Нитрит аммония, нитрат меди (II).
307. Сульфат никеля (II), сульфид натрия.
308. Фосфат аммония, гипохлорит натрия.
309. Сульфид хрома, сульфит калия.
310. Картофель хорошо растет на кислых почвах при рН = 5. Рассчитайте концентрацию ионов Н+ и ОН- в такой почве.
311. После кислования солонцовой почвы концентрация гидроксид-ионов изменилась с 10-10 до 10-8 моль/л. Рассчитайте начальное и конечное значение рН почвы.
312. Рассчитайте концентрацию ионов Н+ и ОН- в почве до известкования (рН=4) и после известкования (рН=6).
313. Рассчитайте рН 0,001 М раствора аммиачной воды (α=1%), применяемой в качестве азотного удобрения.
314. Карбонатная буферная система крови состоит из 0,01М раствора угольной кислоты и 0,1М раствора гидрокарбоната натрия. Как изменится рН-среды при увеличении концентрации углекислоты в10 раз? Кк(Н2СО3) = 4,5 ∙10-5.
315. Одной из буферных систем крови является фосфатная. В каких молярных соотношениях следует взять растворы солей дигидрофосфата и гидрофосфата натрия, чтобы получить буферную систему с рН=7,35? Кк=6,2 ∙10-8.
316. Ацетатная буферная система (СН3СООН + СН3СООNa) вводится во влажное зерно, с целью его консервирования. Вычислите как изменится pH буферного раствора, содержащего по 0,1М СН3СООН и СН3СООNa, если прилить: а) 0,1М раствор HCl; б) 0,1М раствор NaOH. Кк (СН3СООН) = 1,75·10-5.
317. Для восполнения недостатка протеина в рационе жвачных животных используют аммиачную воду и хлорид аммония. Вычислите pH аммиачной буферной системы, состоящей из 0,5 М растворов гидроксида и хлорида аммония. Как изменится pH среды при добавлении к 1л этой смеси: а) 0,1М раствора соляной кислоты; б) 0,1М раствора гидроксида натрия. Kд =1,76∙10-5.
318. Дайте определение понятию буферные растворы. Какими свойствами они обладают? Приведите примеры.
319. Приведите формулы соединений, входящих в состав карбонатного буферного раствора. Объясните механизм буферного действия на примере взаимодействия карбонатного буферного раствора с гидроксидом калия и соляной кислотой.
320. Приведите формулы соединений, входящих в состав фосфатного буферного раствора. Объясните механизм буферного действия на примере взаимодействия фосфатного буферного раствора с NaOH. Что такое буферная емкость?
321. Приведите формулы соединений, входящих в состав ацетатного буферного раствора. Объясните механизм буферного действия на примере взаимодействия ацетатного буферного раствора с соляной кислотой и гидроксидом натрия.
322. Приведите формулы соединений, входящих в состав аммиачного буферного раствора. Объясните механизм буферного действия на примере реакций аммиачного буферного раствора с NaOH. Что такое буферная емкость?
323. Приведите формулы соединений, входящих в состав фосфатного буферного раствора. Объясните механизм буферного действия на примере взаимодействия фосфатного буферного раствора с HCl. Биологическое значение фосфатного буферного раствора.
324. Приведите формулы соединений, входящих в состав ацетатного буферного раствора. Объясните механизм буферного действия на примере взаимодействия ацетатного буферного раствора с соляной кислотой. Биологоическое значение ацетатного буферного раствора.
2.12. Окислительно-восстановительные реакции.
Окислительно-восстановительными называются реакции, сопровождающие-ся изменением степени окисления атомов, входящих в состав реагирующих веществ. Под степенью окисления (n) понимают тот условный заряд атома, который вычисляется исходя из предположения, что молекула состоит только из ионов. Иными словами: степень окисления – это тот условный заряд, который приобрел бы атом элемента, если предположить, что он принял или отдал то или иное число электронов.
Окисление – восстановление – это единый, взаимосвязанный процесс. Окисление приводит к повышению степени окисления восстановителя, а восстановление – к ее понижению у окислителя.
Повышение или понижение степени окисления атомов отражается в электронных уравнениях; окислитель принимает электроны, а восстановитель их отдает. При этом не имеет значения, переходят ли электроны от одного атома к другому полностью и образуются ионные связи или электроны только смещаются к более электроотрицательному атому и возникает полярная связь.
О способности того или иного вещества проявлять окислительные, восстановительные или двойственные (как окислительные, так и восстановительные) свойства можно судить по степени окисления атомов окислителя и восстановителя.
Атом того или иного элемента в своей высшей степени окисления не может ее повысить (отдать электрон) и проявляет только окислительные свойства, а в своей низшей степени окисления не может ее понизить (принять электрон) и проявляет только восстановительные свойства.
Атом элемента в промежуточной степени окисления может проявлять как окислительные, так и восстановительные свойства.
Например, атомы в степени окисления:
| N5+(HNO3) | S6+(H2SO4) | è | проявляют только окислительные свойства | |
| N 4+ (NO2) | S 4+ (SO2) | è | проявляют окислительные и восстановительные свойства | |
| N 3+ (HNO2) | ||||
| N 2+ (NO) | S2+ (SO) | |||
| N 1+(N 2 O) | ||||
| N 0(N 2) | S 0(S 2; S 8) | |||
| N1-(NH2OH) | ||||
| N 2-(N 2H 4) | è | проявляют только восстановительныесвойства | ||
| N 3-(NH 3) | S 2-(H2S) | |||
Пример 1. Исходя из степени окисления атомов азота, серы и марганца в соединениях: NH3, HNO2, HNO3, H2S, H2SO3, H2SO4, MnO2, KMnO4. определите, какие из них могут быть только восстановителями, только окислителями и какие проявляют как окислительные, так и восстановительные свойства.
Р е ш е н и е. Степени окисления N в указанных соединениях соответственно равны: -3 (низшая) NH3, +3 (промежуточная) HNO2, +5 (высшая) HNO3; степени окисления S соответственно равны: -2 (низшая) H2S, +4 (промежуточная) H2SO3, +6 (высшая) H2SO4; cтепени окисления Mn соответственно равны: +4 (промежуточная) MnO2, +7 (высшая) KMnO4. Отсюда: NH3, H2S - только восстановители; HNO3, KMnO4 – окислители; MnO2, HNO2, H2SO3 – могут быть окислителями или восстановителями в зависимости от природы другого компонента реакции.
Пример 2. Могут ли происходить окислительно-восстановительные реакции между следующими веществами: а) H2S и HI, б) H2S и H2SO3
в) H2SO3 и HClO4?
Ре ш е н и е: а) степень окисления атома серы в H2S равна -2; степень окисления атома иода в HI равна -1. Так как и сера, и йод находятся в низшей своей степени окисления, то оба взятые вещества проявляют только восстановительные свойства и взаимодействовать друг с другом не могут; б) степень окисления атома серы в H2S равна -2 (низшая); а в H2SO3 равна +4 (промежуточная). Следовательно, взаимодействие этих веществ возможно, причем H2SO3 будет выступать в роли окислителя; в) степень окисления атома серы в H2SO3 равна +4 (промежуточная); степень окисления атома хлора в HClO4 равна +7 (высшая). Взятые вещества могут взаимодействовать, H2SO3 в этом случае будет проявлять восстановительные свойства.
Пример 3. Расставьте коэффициенты в уравнении окислительно-восстановительной реакции: KMn7+O4 + H3P3+O3 + H2SO4 = Mn2+SO4 + H3P5+O4+K2SO4+H2O
Р е ш е н и е. Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты подбирают методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяет свою степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях:
| Восстановитель
Окислитель | Р3+ - 2е = Р5+
Mn7+ + 5e = Mn2+ |
10 | 5 | Процесс окисления
|
| 2 |
Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Наименьшее общее кратное для числа отданных и принятых электронов десять. Разделив число 10 на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят методом подбора. Уравнение реакции имеет вид:
2 KMnO4 + 5 H3PO4 + 3 H2SO4 = 2 MnSO4 + 5 H3PO4 + K2SO4 + 3 H2O
Пример 4. Составьте уравнение реакции цинка с концентрированной серной кислотой, учитывая максимальное восстановление последней.
Р е ш е н и е. Цинк, как любой металл, проявляет только восстановительные свойства. В концентрированной серной кислоте окислительную функцию несет атом серы (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как p- элемента VI A – группы -2. Цинк, как металл II B – группы, имеет постоянную степень окисления +2. Отражаем сказанное в электронных уравнениях:
| Восстановитель Окислитель | Zn0-2e=Zn2+ S6++8e=S2─ | 8 | 4 1 | Процесс окисления Процесс восстановления |
Составляем уравнение реакции:
4 Zn + 5 H2SO4 = 4 ZnSO4 + H2S↑ + 4 H2O
Перед H2SO4 стоит коэффициент 5, а не 1, ибо четыре молекул H2SO4 идут на связывание четырех ионов Zn+2 и только одна на получение сероводорода.
325. Исходя из степени окисления хлора в соединениях HCl, HClO, HClO3, HClO4, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании метода электронного баланса расставьте коэффициенты в уравнении реакции, идущей по схеме:
KBr + KBrO3 + H2SO4 = Br2 + K2SO4 + H 2O.
326. Реакции выражаются схемами:
P + HIO3 + H 2O = H3PO4 + HI
H2S + Cl2 + H 2O = H2SO4 + HCl
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакции. Для каждой реакции укажите окислитель и восстановитель; процессы окисления и восстановления.
327. а) Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих реакциях:
As3- → As 5+; N 3+ → N 3-; S 2- → S 0.
б) На основании электронных уравнений полуреакций расставьте коэффициенты в уравнении реакции, идущей по схеме:
Na2SO3 + KMnO4 + H 2O = Na2SO4 + MnO2↓ + KOH.
328. а) Исходя из степени окисления фосфора в соединениях PH3, H3PO4, H3PO3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? б) На основании электронных уравнений полуреакций расставьте коэффициенты в уравнении реакции, идущей по схеме:
PbS + HNO3 → S + Pb(NO3)2 + NO + H 2О;
329. Расставьте коэффициенты с использованием метода электронного баланса в следующих окислительно-восстановительных реакциях, идущих по схемам:
P + HNO3 + H 2О → H3PO4 + NO;
KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H 20
330. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление – происходит при следующих превращениях:
а) Mn6+ → Mn2+; б) Cl5+ → Cl─; в) N3─ → N5+
На основании уравнений электронного баланса расставьте коэффициенты в уравнении реакции, идущей по схеме:
Cu º + HNO3 → Cu(NO3)2 + NO + H 2О.
331. Уравняйте с использованием метода электронного баланса следующие окислительно-восстановительные реакции, идущие по схемам:
HNO3 + Ca → Ca(NO3)2 + H 2О+ NH4NO3;
K 2S + KMnO4 + H 2SO4 → S + K 2SO4 + MnSO4 + H 2О
Определите окислитель и восстановитель, процессы окисления и восстановления.
332. Исходя из степени окисления атомов хрома, йода и серы в соединениях K2Cr2O7, KI, H2SO3, определите, какое из них является только окислителем, только восстановителем и какое может проявлять как окислительные, так и восстановительные свойства. Почему? На основании метода электронного баланса расставьте коэффициенты в уравнении реакции, идущей по схеме:
NaCrO2 + PbO2 + NaOH → N a 2CrO4 + Na2PbO2 + H 20
333-342. На основании метода электронного баланса расставьте коэффициенты в уравнениях реакций, идущих по схемам. Определите окислитель и восстановитель, процессы окисления и восстановления
333. H 2S + Cl2 + H2O → H 2SO4 + HCl;
K 2Cr2O7 + H 2S + H 2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O;
334. KClO3 + Na2SO3 → KCl + Na2SO4;
KMnO4 + HBr → Br2 + KBr + MnBr2 + H 2O;
335. P + HClO3 + H 2O → H 3PO4 + HCl;
H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + MnSO4 + K2SO4 + H 2O;
336. FeS + HNO3 = Fe(NO3)3 + S + NO + H 2O;
NаCrO2 + Br2 + NaOH → Na2CrO4 + NaBr + H 2O;
337. HNO3 + Zn → N2O + Zn(NO3)2 + H 2O;
FeSO4 + KClO3 + H2SO4 → Fe2(SO4)3 + KCl + H 2O;
338. K2Cr2O7 + HCl → Cl2 + CrCl3 + KCl + H 2O;
Au + HNO3 + HCl → AuCl3 + NO + H 2O;
339. HCl + CrO3 → Cl2 + CrCl3 + H 2O;
Cd + KМnO4 + H2SO4 → CdSO4 + MnSO4 + K2SO4 + H 2O;
340. Cr2O3 + KClO3 + KOH → K 2CrO4 + KCl + H 2O;
Mn(NO3)2 + PbO2 + HNO3 → HMnO4 + Pb(NO3)2 + H 2º.
341. H 2SO3 + HClO3 → H 2SO4 + HCl;
FeSO4 + K2Cr2O7 + H2SO4 → Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O;
342. I2 + Cl 2 + H 2О = HIO3 + HCl;
K2Cr2O7 + H3PO3 + H2SO4 → Cr2(SO4)2 + H3PO4 + K 2SO4 + H 2O.
343. Могут ли протекать окислительно – восстановительные реакции между веществами: а) NH3 и KMnO4; б) HNO2 и HI; в) HClи H2Se. Почему? На основании электронных уравнений баланса расставьте коэффициенты в уравнении реакции, идущей по схеме:
KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H 2O;
344. Могут ли протекать окислительно – восстановительные реакции между веществами: а) PH3 и HBr; б) K2Cr2O7 и H3PO3; в) HNO3 и H 2S? Почему? На основании электронных уравнений баланса расставьте коэффициенты в уравнении реакции, идущей по схеме:
AsH 3 + HNO3 → H3AsO4 + NO2 + O2
345. Исходя из строения атомов элементов, укажите, какие из ионов могут играть роль восстановителя и почему: Ag+, Fe3+, Cl─, S─2?
346. Какие из ионов Cu2+, S2─, Br─, Fe3+, Al3+могут играть роль окислителя, а какие не могут и почему? Ответ мотивируйте.
347. Закончите уравнения реакций (учтите, что концентрированная HNO3восстанавливается до NO2, а разбавленная – до NO):
C + HNO3 = CO2 + +?
разб.
S + HNO3 = SO2+ +?
разб.
Ag + HNO3 = AgNO3+ +?
конц.
Составьте электронные уравнения баланса, подберите коэффициенты в уравнениях.
348. Закончите уравнения реакций (учтите, что хром восстанавливается до степени окисления +3): C + K2Cr2O7 + H2SO4 = CO2 +?
HI + K2Cr2O7 + H 2SO4 = I2 +?
H 2S + K2Cr2O7 + H 2SO 4 = S +?
Составьте электронные уравнения баланса, подберите коэффициенты в уравнениях.
349. При взаимодействии магния с разбавленной HNO3 образуются нитрат магния, оксид азота (I) и вода. Напишите уравнение реакции и методом электронного баланса подберите коэффициенты.
350. Как изменяется восстановительная способность металлов и окислительная способность их ионов в ряду напряжений? Поясните на конкретных примерах, какими реакциями можно воспользоваться для изучения сравнительной активности металлов.
351. Укажите в периодической системе элементы, обладающие наиболее сильными восстановительными свойствами; наиболее сильными окислительными свойствами. Ответ мотивируйте строением атомов этих элементов. Приведите два примера окислительно – восстановительных реакций.
352. Какие из приведённых реакций являются окислительно – восстановительными? Для окислительно – восстановительных реакций составьте электронные уравнения и укажите, какое вещество окисляется и какое восстанавливается:
2 FeCl3 + H2S = 2 FeCl2 + S↓ + 2 HCl
FeSO4 + H2S = FeS + H2SO4
2 KI + Cl2 = 2 KCl + I2
2.13. Химические свойства неметаллов.
Химических элементов-неметаллов всего 22, но два из них, кислород и кремний составляют 76 % от массы земной коры. Неметаллы составляют 98,5 % от массы растений и 97,6 % от массы человека. Из углерода, водорода, кислорода, серы, фосфора и азота состоят все важнейшие органические вещества, они являются элементами жизни. Водород и гелий – основные элементы Вселенной, из них состоят все космические объекты, включая наше Солнце. Без соединений неметаллов невозможно представить нашу жизнь, особенно если вспомнить, что жизненно важное химическое соединение – вода – состоит из атомов водорода и кислорода.
Неметаллы – это химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы.
Практически все неметаллы имеют сравнительно малые радиусы и большое число электронов на внешнем энергетическом уровне от 4 до 7, для них характерны высокие значения электроотрицательности и окислительные свойства.
 2020-10-10
2020-10-10 793
793








