По типу используемых химических реакций методы титриметрического анализа разделяют на три группы: 1) методы, основанные на реакциях соединения ионов; 2) методы, основанные на реакциях окисления-восстановления; 3) методы, основанные на реакциях комплексообразования. К первой группе относят методы кислотно-основного и осадительного титрования, ко второй – различные методы окислительно-восстановительного титрования и к третьей – методы комплексометрического титрования.
Метод кислотно-основного титрования (или нейтрализации) основан на взаимодействии кислот с основаниями, или, иначе говоря, на соединении протонов с гидроксид-ионами:
H+ + OH– 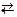 H2O + 57,32 Дж.
H2O + 57,32 Дж.
Точку эквивалентности при нейтрализации определяют по изменению окраски индикатора (метилового оранжевого, метилового красного, фенолфталеина и др.).
Осадительное титрование основано на реакциях осаждения между определяемым веществом и титрантом. Титриметрическим методам осаждения дают названия в зависимости от вида титранта. Например, если для этого используют раствор нитрата серебра AgNO3, то метод называют аргентометрией, если пользуются рабочим раствором тиоцианата аммония NH4SCN – тиоцианатометрией и т. д.
Методы комплексометрического титрования объединяют титриметрические определения, основанные на образовании комплексных соединений (ионов или молекул). С помощью этих методов определяют различные катионы (Mg2+, Са2+, Zn2+, Hg2+, Al3+) и анионы (CN–, F–, Cl–), обладающие свойством вступать в реакции комплексообразования. Широкое распространение имеют методы анализа, основанные на взаимодействии катионов с органическими реактивами – комплексонами. Такое титрование называют комплексонометрическим.
Методы окислительно-восстановительного титрования (редокс-методы) основаны на окислительно-восстановительных реакциях между анализируемым веществом и титрованным раствором.
Используют их для количественного определения в растворах различных восстановителей (Fe2+, C2О  , NO
, NO  и др.) или окислителей (Cr2O
и др.) или окислителей (Cr2O  , MnO
, MnO  , ClO
, ClO  , Fe3+ и др.).
, Fe3+ и др.).
Известно несколько десятков различных методов ОВ-титрования. Их классифицируют по различным признакам.
Классификация по характеру титранта:
1) оксидиметрия – титрантом является окислитель (КMnО4, К2Cr2О7 и др.);
2) редуктометрия – в качестве титранта используется восстановитель (KI, Na2S2O3).
Классификация по природе реагента, взаимодействующего с определяемым веществом. Название метода зависит от названия реагента:
1) Перманганатометрия (КМnО4 – титрант). Перманганат калия (КМnО4) проявляет окислительные свойства в различной среде:
в кислой j0(MnO  , 8H+½Mn2+ + 4Н2О) = 1,51 В;
, 8H+½Mn2+ + 4Н2О) = 1,51 В;
в нейтральной j0(MnO  , Н2О½MnО2 + 4ОН–) = +0,54 В;
, Н2О½MnО2 + 4ОН–) = +0,54 В;
в щелочной j0(MnO  ½MnО
½MnО  ) = +0,60 В.
) = +0,60 В.
При сравнении ОВ-потенциалов видно, что наиболее активно перманганат калия проявляет окислительные свойства в кислой среде. Кроме того, в кислой среде в процессе титрования анализируемого раствора восстановителя малиново-фиолетовая окраска иона MnO  исчезает при переходе в Mn2+. В точке эквивалентности избыточная капля раствора КМnО4 окрашивает титруемый раствор в розовый цвет. Индикатором является сам титрант – перманганат калия. При титровании в слабощелочной или нейтральной среде перманганат-анион восстанавливается до Mn (IV). При этом выпадает бурый осадок MnО2¯, на фоне которого затрудняется определение точки эквивалентности. Следовательно, лучшей средой при титровании в перманганатометрии является кислая (Н2SO4).
исчезает при переходе в Mn2+. В точке эквивалентности избыточная капля раствора КМnО4 окрашивает титруемый раствор в розовый цвет. Индикатором является сам титрант – перманганат калия. При титровании в слабощелочной или нейтральной среде перманганат-анион восстанавливается до Mn (IV). При этом выпадает бурый осадок MnО2¯, на фоне которого затрудняется определение точки эквивалентности. Следовательно, лучшей средой при титровании в перманганатометрии является кислая (Н2SO4).
2) Дихроматометрия (титрант К2Сr2O7). В кислой среде дихромат-анион восстанавливается до Cr3+:
Сr2O  + 6e – + 14H+ = 2Сr3+ + 7Н2О;
+ 6e – + 14H+ = 2Сr3+ + 7Н2О;
j0(Cr2O  , H+½2Сr3+) = 1,33 В.
, H+½2Сr3+) = 1,33 В.
Как видно, для К2Сr2O7 характерен более низкий потенциал (j0 = 1,33 В), чем для КMnО4 в кислой среде (j0 = 1,51 В). Поэтому окислительные свойства К2Cr2О7 несколько слабее окислительных свойств КMnО4. Но дихромат калия имеет свои достоинства:
– из него можно готовить первичный стандартный раствор;
– дихромат калия не окисляет хлорид-ионы, поэтому возможно титрование в присутствии HCl;
– раствор устойчив при хранении.
Индикатором дихроматометрии служит дифениламин, окрашивающий раствор в синий цвет при малейшем избытке дихромата.
3) Иодометрия – это метод ОВ-титрования, основанный на реакции взаимодействия иодид-ионов с окислителем Ох, приводящей к образованию иода и восстановителя:
2I– + Ox = I2 + Red.
Иодид-ионы относятся к хорошим восстановителям, но растворы иодидов неустойчивы при хранении, окисляются кислородом воздуха и в качестве титрантов не применяются. В качестве титранта используется стандартный раствор тиосульфата натрия Na2S2O3.
К анализируемому раствору определяемого окислителя прибавляют избыток иодида калия. Выделяющийся иод оттитровывают стандартным раствором тиосульфата натрия:
I2 + 2Na2S2O3 = 2NaI + Na2S4O6.
Количество израсходованного титранта Na2S2O3 эквивалентно количеству образовавшегося иода и, следовательно, количеству определяемого окислителя Ох, взаимодействовавшего с иодид-ионами.
В качестве индикатора в иодометрии обычно используют свежеприготовленный 1%-ный раствор крахмала.
 2020-10-10
2020-10-10 277
277








