Кривые кислотно-основного титрования графически отображают зависимость изменения рН титруемого раствора от объема прибавленного титранта или степени оттитрованности f. По оси абсцисс откладывают объем прибавленного титранта или степень оттитрованности. По оси ординат откладывают значения рН (рН = – lg [H+]) и получают логарифмическую кривую титрования. Анализ кривых титрования позволяет определить интервал DрН раствора вблизи ТЭ, т. е. величину скачка на кривой титрования, и выбрать подходящий индикатор так, чтобы значение показателя титрования рТ индикатора укладывалось внутри скачка рН на кривой титрования.
Для построения кривой кислотно-основного титрования рассчитывают значения рН титруемого раствора в различные моменты титрования: рН исходного раствора; до точки эквивалентности (ТЭ); в точке эквивалентности и после точки эквивалентности.
В кислотно-основном титровании расчет рН в разные моменты титрования зависит от силы кислоты или основания, используемых в титровании. Различают следующие виды титрования:
– сильной кислоты сильным основанием;
– слабой кислоты сильным основанием;
– слабого основания сильной кислотой;
– многоосновных кислот сильным основанием;
–солей, образованных катионами сильных оснований и анионами слабых кислот.
Титрование сильной кислоты сильным основанием. При титровании сильной кислоты щелочью до ТЭ значение рН титруемого раствора определяется концентрацией исходной сильной кислоты. Для простоты расчетов допустим, что ионная сила раствора не изменяется, пренебрегаем изменением объема, принимаем значение степени диссоциации сильной кислоты равным единице. При этих допущениях для расчета рН до точки эквивалентности можно пользоваться уравнением:
рН = –lg С (К) – lg(1 – f), (1)
где С (К) – концентрация сильной кислоты, моль/л;
f – степень оттитрованности, f = V (T)/ V (K),
V(T) – объем титранта (сильного основания),
V(K) – объем сильной кислоты.
В ТЭ значение рН определяется концентрацией ионов водорода, поступающих за счет автопротолиза воды (если считать, что СО2 не поглощается):
Н+ + ОН–  Н2О;
Н2О;
рН = –lg10–7 = 7. (2)
Среда в ТЭ – нейтральная.
За ТЭ значение рН определяется избытком добавленного титранта – сильного основания, рН рассчитывается по уравнению:
pH = pKв + lg С (T) + lg(f – 1), (3)
где рКв – постоянная воды (рКв = 14);
С(Т) – концентрация титранта (щелочи), моль/л.
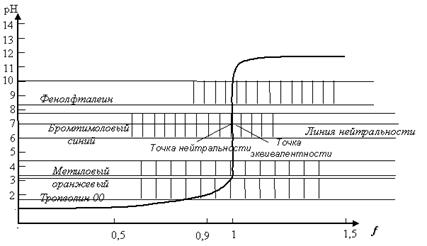
Результаты вычислений изображают графически: на оси абсцисс откладывают степень оттитрованности, а на оси ординат - соответствующие значения рН раствора. Получающийся график называют кривой титрования. Кривая титрования 0,1н раствора хлороводородной кислоты 0,1н раствором гидроксида натрия показана на рисунке 5.
На графике видно, что в конце титрования сильной кислоты сильным основанием происходит резкий скачок в изменении рН раствора.
 2020-10-10
2020-10-10 392
392








