Благородные металлы -металлы, не подверженные коррозии и окислению, что отличает их от большинства металлов. Все они являются также драгоценными металлами, благодаря их редкости. Основные благородные металлы — золото, серебро, а также платина и остальные 5 металлов платиновой группы — (рутений, родий, палладий, осмий, иридий).
Бура – Na2B4O7.
Бурый газ -оксид азота (IV) (диоксид азота, бурый газ) NO2 — газ, красно-бурого цвета, с характерным острым запахом.
Бюкс – стаканчик с пришлифованной крышкой, используемый для хранения, взвешивания и высушивания веществ.
Бюретка – цилиндрический градуированный сосуд с краном или резиновым затвором, используемый для измерения объема реактива при титровании.
Буферные растворы – растворы с определенной концентрацией ионов водорода, незначительно меняющие рН при разбавлении, концентрировании, а также при добавлении небольших количеств сильной кислоты или щелочи.
Валентность (от лат. valens — «имеющий силу») — способность атомов химических элементов образовывать химические связи с атомами других элементов. В свете строения атома валентность - это способность атомов отдавать или присоединять определенное число электронов.
Веселящий газ - оксид азота (I) (оксид диазота, закись азота, веселящий газ) — соединение с химической формулой N2O.
Внутренняя энергия тела (U) складывается из кинетической энергии хаотического движения молекул, потенциальной энергии взаимодействия между ними и внутримолекулярной энергии.
Внутрикомплексные соединения (хелаты) – циклические комплексы металлов с полидентатными лигандами, в которых центральный атом входит в один или одновременно в несколько циклов.
Вода (оксид водорода) — прозрачная жидкость, не имеющая цвета (в малом объёме) и запаха. Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. 71 % поверхности Земли покрыто водой (океаны, моря, озера, реки). Является хорошим сильнополярным растворителем.
Водородный показатель (рН) – количественная характеристика кислотности водных растворов; численно равен отрицательному десятичному логарифму концентрации (активности) ионов водорода:
рН = -lg [H+]
Водородная связь — разновидность невалентного (специфического) взаимодействия между атомом водорода H, ковалентно связанным с атомом A группы A-H молекулы RA-H и электроотрицательным атомом B другой молекулы (или функциональной группы той же молекулы) BR'. Результатом таких взаимодействий являются комплексы RA-H•••BR различной степени стабильности, в которых атом водорода выступает в роли мостика, связывающего фрагменты RA и BR. Атом водорода, соединенный с атомом сильно электроотрицательного элемента (например, N, O, F), способен к образованию еще одной химической связи с другим сильно электроотрицательным атомом. Эта связь называется водородной.
Водяной газ -газовая смесь, состав которой (%) CO — 44, N2 — 6, CO2 — 5, H2 — 45. Используется как горючий газ (теплота сгорания 2800 ккал/м³), а также применяется в химическом синтезе — для получения аммиака, метанола, высших спиртов и др.
Гашеная известь (пушонка) – сухой Са(ОН)2.
Гибридизация орбиталей — концепция смешения разных, но близких по энергии орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по энергии и форме. Гибридизация атомных орбиталей происходит при возникновении ковалентной связи между атомами.
Гидролиз солей – взаимодействие ионов соли с молекулами воды, приводящее к образованию слабого электролита.
Гипосульфит натрия – Na2S2O3·5H2O
Гипс – минерал из класса сульфатов, по составу CaSO4•2H2O.
Главное (радиальное) квантовое число — целое число, обозначающее номер энергетического уровня. Характеризует энергию электронов, занимающих данный энергетический уровень.
Глауберова соль – Na2SO4 · 10H2O, десятиводный кристаллогидрат (декагидрат) сульфата натрия. Применяется в стекольном и содовом производстве, в медицине.
Глинозем – оксид алюминия Al2O3.
Гравиметрия – методы количественного анализа, основанные на измерении массы веществ.
Градуировочный график – графическое выражение количественной связи концентрации отдельных компонентов анализируемого вещества с определенными физическими параметрами.
Градус жесткости (0Ж) – российская единица измерения жесткости природной и питьевой воды, введенная в действие с 1.01.2005г., один градус жесткости соответствует содержанию в одном дм3 воды 20,04 мг ионов кальция или 12,16 мг ионов магния.
Гремучая смесь (гремучий газ) – смесь двух объемов Н2 и одного объема О2.
Группа периодической системы химических элементов — последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением. Номер группы определяется количеством валентных электронов и, как правило, соответствует высшей валентности атома.
Декантация – способ фильтрования, при котором отстоявшуюся жидкость осторожно сливают с осадка на фильтр, стараясь не взмутить осадок.
Дентатность – число донорных атомов лиганда, образующих координационные связи с центральным атомом.
Диаммофос (минеральное удобрение) - водорастворимая соль, образующаяся при взаимодействии аммиака и фосфорной кислоты. Химическая формула (NH4)2HPO4.
Диспропорционирование (дисмутация) — химическая реакция, в которой один и тот же элемент выступает и в качестве окислителя, и в качестве восстановителя, причём в результате реакции образуются соединения, которые содержат один и тот же элемент в разных степенях окисления.
Диссоциация электролитическая – распад растворенного вещества на ионы в результате сольватации его молекул молекулами растворителя.
Доломит – CaCO3∙MgCO3
Донор электронов - атом менее электроотрицательного химического элемента, отдающий свою неподелённую электронную пару для образования химической связи.
Донорно-акцепторный механизм (координационная связь) — химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора).
Едкий барит – Ba(OH)2∙8H2O
Едкий натр – NaOH
Едкое кали – KOH
Жавелевая вода – раствор хлора Cl2 в водном растворе гидроксида натрия или гидроксида калия; главный компонент – гипохлорит натрия NaClO или калия KClO.
Железные квасцы – соли с общей формулой Me2SO4 х Fe2(SO4)3 х 24H2O (где Me — К, Na, NH4 и др.). Ж. к. — комплексные соединения, их формулы часто дают так: Me[FeSO4)2]-12H2O. Железо-аммониевые квасцы применяют в аналитической химии.
Железный колчедан (серный колчедан) – FeS2.
Железный купорос – FeSO4∙7H2O.
Желтая кровяная соль – K4[Fe(CN)6].
Жесткость воды – свойство природной воды, определяемое присутствием в ней растворенных солей кальция и магния; является одним из важнейших показателей качества воды.
Жженая известь (кипелка) – CaO.
Жидкое стекло (растворимое стекло) - водный щелочной раствор силикатов натрия (Na2Si2O3)n и (или) калия (K2Si2O3)n.
Закон Авогадро. В равных объемах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержится одно и то же число молекул.
Закон Гесса — основной закон термохимии, который формулируется следующим образом: Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Закон кратных отношений – если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа. Открыт Дж. Дальтоном в 1808 г.
Закон объемных отношений – при одинаковых условиях объемы вступающих в реакцию газов, относящихся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа. Открыт Ж. Гей-Люссаком в 1805 г.
Закон эквивалентов в титриметрии: в точке эквивалентности число эквивалентов титранта равно числу эквивалентов оттитрованного веществ. Математическое выражение закона (основное уравнение титриметрии): Ст · Vт = Сх · Vх, Ст – молярная концентрация эквивалентов титранта, моль/л; Vт – объем израсходованного титранта, мл; Сх – молярная концентрация эквивалентов определяемого вещества, моль/л; Vх – объем анализируемого раствора, мл.
Закон сохранения массы Ломоносова - Лавуазье: Масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции.
Закон сохранения энергии: При любых взаимодействиях, имеющих место в изолированной системе, энергия этой системы остается постоянной и возможны лишь переходы из одного вида энергии в другой.
Закон постоянства состава. Любое химически индивидуальное соединение имеет один и тот же количественный состав независимо от способа его получения
Известь (гидроксид кальция) — химическое вещество, сильное основание, формула Ca(OH)2. Представляет собой порошок белого цвета, плохо растворимый в воде.
Известковая вода (известковое молоко) – насыщенный водный раствор гидроксида кальция.
Известняк – СаСО3.
Изотопы – атомы одного элемента, содержащие в своих ядрах одинаковое число протонов, но различное число нейтронов. Например, 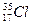 и
и 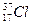 .
.
Индикаторы – органические и неорганические вещества, позволяющие устанавливать конечную точку титрования (КТТ).
Индикаторы кислотно-основные (рН – индикаторы) – вещества, изменяющие окраску в зависимости от кислотности среды (рН); применяются для установления КТТ в кислотно-основном титровании и определения рН растворов.
Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.
Ионное произведение воды (постоянная воды или константа автопротолиза) – величина, равная произведению концентраций (точнее активностей) ионов водорода и гидроксид-ионов в воде и водных растворах: Кв = 10-14 (при 22 °С).
Ионный радиус — понятие, принятое для обозначения размеров шарообразных ионов и вычисления межатомных расстояний в ионных соединениях.
Калиевая селитра, индиийская селитра (минеральное удобрение) – KNO3.
Каломель – Hg2Cl2.
Кальциевая селитра (минеральное удобрение) – Ca(NO3)2.
Кальцит – CaCO3.
Каменная соль (поваренная соль) – NaCl.
Катод — отрицательный полюс источника тока (гальванического элемента, электрической батареи и т. д.) или электрод некоторого прибора, присоединённый к отрицательному полюсу источника тока.
Каустик – NaOH.
Качественный анализ – раздел аналитической химии, изучающий методы обнаружения (идентификации) компонентов анализируемых веществ.
Квантовое число — численное значение какой-либо квантованной переменной микроскопического объекта (элементарной частицы, ядра, атома и т. д.), характеризующее состояние частицы.
Кварц – SiO2.
Киноварь – HgS.
Кислоты — один из основных классов химических соединений. Они получили своё название из-за кислого вкуса большинства кислот, таких, как азотная или серная. По определению кислота — это электролит (вещество, участвующее в реакциях с переходом электрона), отдающий электрон в реакции с основанием, то есть веществом, принимающим электрон. В свете теории электролитической диссоциации кислота — это электролит, при электролитической диссоциации из катионов образуются лишь катионы водорода.
Кислотные оксиды (ангидриды) – оксиды, проявляющие кислотные свойства. Образуются типичными неметаллами и некоторыми переходными элементами. Элементы в кислотных оксидах обычно проявляют валентность от IV до VII. Например: оксид углерода(IV) CO2; Оксид серы(IV) SO2; оксид серы(VI) SO3; оксид кремния(IV) SiO2; оксид фосфора(V) P2O5; оксид хрома(VI) CrO3; оксид марганца(VII) Mn2O7.
Ковалентная связь – связь посредством общих электронных пар.
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы). Единица измерения количества вещества в СИ — моль.
Комплексонометрия – метод титриметрического анализа, основанный на применении в качестве титрантов комплексонов, образующих прочные внутрикомплексные соединения с катионами металлов.
Константа равновесия концентрационная (Кс) –величина, выражающая для данной химической реакции соотношение между концентрациями веществ при равновесии, и численно равная отношению произведения концентраций продуктов реакции к произведению концентраций исходных веществ.
Концентрация — величина, характеризующая количественный состав раствора.
Существует много способов выражения концентрации растворов.
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы.
 ,
,
где:
· m1 — масса растворённого вещества, г (кг);
· m — общая масса раствора, г (кг).
 2020-10-10
2020-10-10 219
219








