 или
или 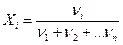 ,
,
где: νi — количество i -го компонента, моль; n — число компонентов.
Концентрированный раствор — раствор с высоким содержанием растворённого вещества в противоположность разбавленному раствору, содержащему малое количество растворённого вещества.
Корунд – Al2O3.
Коэффициент активности ионов (f) – переменный фактор, характеризующий силы взаимодействия между ионами в растворах сильных электролитов: f = 1 – взаимодействие отсутствует, при наличии взаимодействия между ионами f<1.
Количество вещества υ (или n) — это физическая величина, указывающая на число формульных единиц вещества относительно постоянной Авогадро.
Красная кровяная соль – K3[Fe(CN)6].
Кремнезем – SiO2.
Кривая титрования – графический метод изображения процесса титрования, отражающий изменение определяемого параметра титруемого раствора (рН, концентрации, потенциала и др) по мере приливания к нему титранта.
Криолит – Na3AlF6.
Кристаллическая сода – Na2CO3∙10H2O.
Купоросное масло – концентрированная H2SO4.
Лантаноиды (лантаниды) — семейство из 14 химических элементов с порядковыми номерами 58—71, расположенных в VI периоде системы Менделеева за лантаном и сходных с ним по свойствам.
Ляпис – AgNO3.
Магнезит (магнезия белая) – MgCO3.
Магнезия жженая – MgO.
Магнитный известняк – Fe3O4.
Магнитное квантовое число принимает целые значения от - l до + l (где l - орбитальное квантовое число), то есть имеет ровно столько значений, сколько орбиталей существует на каждом подуровне.
Малахит – (CuOH)2CO3.
Марганцовка – водный раствор KMnO4.
Массовая доля компонента (ω) – способ выражения концентрации, равна отношению массы компонента к общей массе системы (раствора, смеси, сплава); единицы – процент (%), промиле (тысячная, доля, 0/00), миллионная доля (млн.), миллиардная доля (млрд.).
Массовое число – сумма протонов и нейтронов в ядре каждого конкретного атома.
Медный колчедан (халькопирит) – CuFeS2.
Медный купорос – CuSO4∙5H2O.
Мел – CaCO3.
Металлическая связь — химическая связь, обусловленная свободными электронами. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Металлы — группа элементов, обладающая характерными металлическими свойствами: высокая тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и др. К металлам относятся примерно 70 % всех химических элементов.
Молекула — наименьшая частица вещества, несущая его химические свойства.
Моль — единица измерения количества вещества. Соответствует количеству вещества, содержащему столько специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц), сколько содержится атомов в 12 граммах нуклида углерода 12C.
Молярная концентрация (Св, моль/л) – отношение количества растворенного вещества (компонента) к объему раствора (системы).
Молярная концентрация эквивалентов (Сэк, моль/л) – отношение количества эквивалентов растворенного вещества к объему раствора.
Молярная масса вещества — масса одного моль вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с массой атома элемента, выраженной в а.е.м. (атомная единица массы).
Молярный объём — объём одного моля вещества, величина, получающаяся от деления молярной массы на плотность. Характеризует плотность упаковки молекул. Согласно закону Авогадро, для любого газа при нормальных условиях эта величина имеет универсальное значение 22,413 996(39) л/моль.
Мочевина (карбамид) – CO(NH2)2.
Мрамор – CaCO3.
Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется. Осадок данного вещества находится в равновесном состоянии с веществом в растворе.
Натр – Na2O.
Натронная известь – смесь гашеной извести Ca(OH)2 с едким натром NaOH.
Нашатырь – NH4Cl.
Негашеная известь (жженая известь) – CaO.
Нейтрон – электронейтральная субатомная частица с массой, несколько превышающей массу протона. Наряду с протоном является составной частью ядер атомов. Число нейтронов определяется по разнице между массовым числом и зарядом ядра.
Неметаллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов.
Ненасыщенный раствор — раствор, в котором концентрация растворенного вещества меньше, чем в насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое его количество.
Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложение взрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ.
Несолеобразующие оксиды — оксиды не проявляющие ни кислотных, ни основных, ни амфотерных свойств и не образующие соли. По сравнению с другими видами, количество несолеобразующих оксидов невелико, их как правило образуют одно- и двухвалентные неметаллы. Типичными представителями таких оксидов являются: оксид азота (I) (закись азота) N2O; оксид азота (II) (монооксид азота) NO; оксид углерода (II) (монооксид углерода) СО; оксид кремния(II) SiO.
Нефелометрия — определение концентрации вещества по интенсивности светового потока, рассеиваемого взвешенными частицами. Нефелометрия позволяет, например, определять с помощью приборов нефелометров молекулярную массу полимеров.
Нитрофос (минарельное удобрение) – азотнофосфорное удобрение.
Нитрофоска (минеральное удобрение) – азотно-фосфорно-калийное удобрение (NH4)2HPO4 + NH4NO3 + KNO3 + CaHPO4 + NH4H2PO4 + KCl
Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например: 3H2 + N2 ⇆ 2NH3
Обжиговый газ – газовая смесь, полученная при обжиге FeS2.
Окислитель — вещество, в состав которого входят атомы, присоединяющие во время химической реакции электроны, иными словами, окислитель — это акцептор электронов.
Окислительно-восстановительные реакции — это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Оксид — соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом.
Олеум – раствор SO3 в безводной H2SO4.
Орбиталь атомная – орбиталь электрона, находящегося в поле атомного ядра и усредненном поле остальных электронов данного атома.
Орбитальное квантовое число (азимутальное) - определяет азимутальное распределение плотности вероятности локализации электрона в атоме, то есть форму электронного облака и определяет энергетический подуровень данного энергетического уровня.
Связано с n - главным (радиальным) квантовым числом соотношением:
Основания (основные гидроксиды) — вещества, молекулы которых состоят из ионов металлов или иона аммония и одной или нескольких гидроксогрупп (гидроксида) –OH-. В водном растворе диссоциируют с образованием катионов и анионов -ОН-.
Основные оксиды – оксиды, образующие соли при взаимодействии с кислотами или кислотными оксидами. К ним относятся: оксиды металлов главной подгруппы первой группы (щелочные металлы) Li — Fr, оксиды металлов главной подгруппы второй группы (щелочноземельные металлы) Mg — Ra, оксиды металлов переходных элементов в низших степенях окисления. Металлы в основных оксидах обычно проявляют валентность I и II.
Относительная атомная масса элемента (сокращенно — атомной массой) - отношение средней массы атома при его природном изотопном сставе к 1/12 массы атома изотопа углерода 12С.
Относительная молекулярная масса (сокращенно — молекулярной массой) вещества - отношение средней массы вещества определенного формульного состава, включающего атомы отдельных элементов в их природном изотопном составе, к 1/12 массы атома изотопа углерода 12С
Периодическая система химических элементов (таблица Менделеева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д.И. Менделеевым в 1869 году.
Периодический закон (современная формулировка) – Строение и свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атомов и определяются периодически повторяющимися однотипными электронными конфигурациями их атомов.
Период — строка периодической системы химических элементов, последовательность атомов по возрастанию заряда ядра и заполнению электронами внешней электронной оболочки.
Песок (кремнезем) – SiO2.
Питьевая сода – NaHCO3.
Плавиковая кислота – HF.
Поташ – K2CO3.
Правило Клечковского (также Правило n+ l; также используется название правило Маделунга) — эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах.
Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел  . При одинаковой сумме раньше заполняется орбиталь с меньшим значением n. . При одинаковой сумме раньше заполняется орбиталь с меньшим значением n.
|
Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным.
Преципитат (минеральное удобрение) – CaHPO4∙2H2O.
Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий (температура, давление, концентрация), то равновесие смещается таким образом, чтобы уменьшить изменение.
Принцип Паули (принцип запрета) — один из фундаментальных принципов квантовой механики, согласно которому два и более тождественных фермиона не могут одновременно находиться в одном квантовом состоянии.
Произведение растворимости (ПР) – произведение концентраций катионов и анионов в насыщенном растворе малорастворимого сильного электролита.
Протолитическая теория кислот и оснований – теория Бренстеда – Лоури, согласно которой кислотой называют соединение, способное отдавать протон, основанием – способное присоединять его.
Протон – положительно заряженная субатомная частица с массой 1,67×10-24 г. Число протонов в ядрах атомов равно порядковому номеру данного элемента.
Постоянная Авогадро - показывает число атомов, содержащихся в 12 г изотопа углерода 12С, или количество атомных единиц массы в 1 г вещества.
Радиусом атома называется расстояние между атомным ядром и самой дальней из стабильных орбит электронов в электронной оболочке этого атома.
Разбавленный раствор - раствор с низким содержанием растворённого вещества.
Раствор — гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из которых называется растворителем, а другой растворимым веществом, это также система переменного состава, находящаяся в состоянии химического равновесия.
Раствор стандартный (рабочий, титрованный, титрант) – раствор реактива точно известной концентрации.
Раствор стандартный первичный (приготовленный) – стандартный раствор, приготовленный по точной навеске исходного вещества. Исходными называют вещества, которые можно легко получить в чистом виде, их состав отвечает точно определенной химической формуле и не изменяется в процессе хранения.
Раствор стандартный вторичный (установленный, стандартизированный) – раствор, точную концентрацию которого находят не по точной навеске, а устанавливают по тому или иному исходному веществу путем титрования.
Растворимость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Роданиды (тиоцианаты)
Роданистая (тиоциановая) кислота – HCNS.
Связь химическая – совокупность сил и различных видов взаимодействия между атомами, благодаря чему становится возможным существование двух- и многоатомных молекул, ионов, радикалов.
Сильвинит – NaCl∙KCl.
Синильная кислота – HCN.
Скорость химической реакции - изменение количества вещества одного из реагирующих веществ за единицу времени в единице реакционного пространства.
Например для реакции:
A + B → C + D
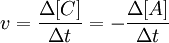 .
.
Сода кальцинировнная – Na2CO3.
Сода каустическая – NaOH.
Сода кристаллическая – Na2CO3∙10H2O.
Сода питьевая – NaHCO3.
Солеобразующие оксиды (ангидриды) — оксиды неметаллов, при взаимодействии с водой образующие соответствующие кислоты, при взаимодействии с основаниями — соответствующие нормальные и кислые соли.
Солеобразующие оксиды, в свою очередь, делятся на: основные оксиды (например, Na2O, CuO); кислотные оксиды (например, SO3, NO2); амфотерные оксиды (например, ZnO, Al2О3).
Соли — вещества, состоящие из катионов металла (или катиона аммония NH4+) и анионов кислотного остатка.
Соль Мора – (NH4)2FeSO4∙6H2O.
Соляная кислота - HCl.
Сродство к электрону – энергия, поглощаемая или выделяющаяся при присоединении электрона к атому, иону, радикалу или молекуле в газовой фазе при Т=0 К без передачи частице кинетической энергии. Выражается в Дж, кДж, электронвольтах (эВ).
Степень диссоциации электролита (α) – величина, характеризующая состояние равновесия в процессах диссоциации электролитов в гомогенных системах; равна отношению числа диссоциированных молекул к исходному числу молекул электролита.
Степень окисления (окислительное число, формальный заряд) — вспомогательная, условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Сулема – HgCl2.
Сухой лед – твердый диоксид углерода CO2.
Тальк – 3MgO∙4SiO2∙H2O.
Термодинамика химическая – раздел термодинамики, изучающий химические и физико-химические процессы, а также термодинамические свойства веществ в зависимости от их состава, агрегатного состояния, температуры, давления.
Титр (Тв, г/мл) – масса растворенного вещества в одном миллилитре раствора.
Титрант – раствор реактива с точно известной концентрацией.
Титриметрия – совокупность методов количественного анализа, основанных на точном измерении объема титранта, необходимого для взаимодействия с определяемым компонентом анализируемого вещества.
Титрование – процесс постепенного добавления контролируемого объема титранта к исследуемому раствору.
Точка эквивалентности (ТЭ) – момент титрования, в котором количество вещества титранта строго эквивалентно количеству вещества определяемого компонента, то есть момент окончания химической реакции между титрантом и определяемым компонентом.
Туки – минеральные удобрения.
Угарный газ – CO/
Углекислота – CO2.
Уксус – 6-9% раствор уксусной кислоты CH3COOH.
Уксусная соль – Ca(CH3COO)2∙H2O.
Уравнение Нернста – уравнение, выражающее зависимость электродного потенциала от концентрации (активности) ионов электрохимической реакции: φ 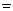 φ0 +
φ0 +  , где φ – электродный потенциал, В; φ0 – стандартный электродный потенциал, В; R – газовая постоянная; Т – температура, К; n – число электронов, участвующих в реакции; F – постоянная Фарадея; Сi – концентрация иона, моль/л.
, где φ – электродный потенциал, В; φ0 – стандартный электродный потенциал, В; R – газовая постоянная; Т – температура, К; n – число электронов, участвующих в реакции; F – постоянная Фарадея; Сi – концентрация иона, моль/л.
Флюорит – CaF2.
Формульные единицы — это реально существующие частицы, представляющие собой электроны, атомы, молекулы, ионы, условные молекулы кристаллических веществ и полимеров и др.
Фосфорит – Ca3(PO4)2.
Фосфоритная мука – минеральное удобрение, получаемое из фосфоритов.
Химическая формула — отражение информации о составе и структуре веществ с помощью химических знаков, чисел и разделяющих знаков — скобок.
Химическое уравнение — это условная запись химической реакции с помощью химических знаков, формул и коэффициентов.
Химия – наука о строении, свойствах веществ, их превращениях и сопровождающих явлениях.
Хлорная вода – водный раствор хлора.
Хроматография — метод разделения и анализа смесей веществ, а также изучения физико-химических свойств веществ. Основан на распределении веществ между двумя фазами — неподвижной и подвижной (элюент).
Хромовая смесь – смесь равных объмов насыщенного раствора K2Cr2O7 и концентрированной H2SO4.
Хромовые квасцы – Cr2(SO4)3∙K2SO4∙24H2O.
Хромпик – K2Cr2O7 или Na2Cr2O7.
Царская водка – смесь концентрированных кислот HNO3 и HCl в объемном соотношении 1: 3.
Цинковая обманка – ZnS.
Цинковый купорос – ZnSO4∙7H2O.
Чилийская селитра (минеральное удобрение) – NaNO3.
Число Авогадро, константа Авогадро (N A) — физическая константа, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле вещества. Определяется как количество атомов в 12 граммах (точно) чистого изотопа углерода-12.
Эквивалент химического элемента – реальная или условная частица элемента, которая присоединяет или замещает один атом водорода или эквивалентна одному электрону в окислительно-восстановительных реакциях.
Экзотермическая реакция — химическая реакция, сопровождающаяся выделением теплоты.
Электрод в электрохимии – материал (металлы, полупроводники), обладающий электронной проводимостью при погружении в раствор электролита: электрод первого рода – металлический; электрод второго рода – металл, покрытый слоем его труднорастворимой соли и погруженный в раствор, содержащий анионы этой соли.
Электрод сравнения – электрод гальванической цепи, потенциал которого не зависит от концентрации определяемых ионов, его потенциал стабилен и воспроизводим.
Электродный потенциал (φ, В) – разность электростатистических потенциалов между электродом и находящимся с ним в контакте электролитом.
Электродный потенциал стандартный (φ0, В) – электродный потенциал, измеренный относительно стандартного водородного электрода при условиях: активности ионов в электролите равны 1 моль/л, внешнее давление равно 101325 Па (1 атм), температура – 298 К.
Электролиты (ионные проводники) – вещества, растворы и расплавы которых проводят электрический ток.
Электрон – элементарная отрицательно заряженная частица. характеризующаяся зарядом 1,6×10-19 Кл и массой 9,1×10-20 г. Число электронов в атоме определяется зарядом ядра атома. Каждый электрон в атоме однозначно характеризуется своим набором четырех квантовых чисел: главного n, орбитального l, магнитного ml и спинового ms. В невозбужденном состоянии все электроны характеризуются наименьшей энергией.
Электронная конфигурация – последовательность распределения электронов по орбиталям. Расшифровка электронной конфигурации. По историческим причинам в формуле электронной конфигурации квантовое число l записывается латинской буквой. Состояние с l = 0 обозначается буквой s, l = 1 — p, l = 2 — d, l = 3 — f, l = 4 — g и далее по алфавиту. Слева от числа l пишут число n, а сверху от числа l — число электронов в состоянии с данным n, l. Например 2 s 2 соответствует двум электронам в состоянии с n = 2, l = 0. В полной формуле электронной конфигурации термы пишут в порядке возрастания квантового числа n, а затем квантового числа l, например 1 s 22 s 22 p 63 s 23 p 2.
Электронная оболочка атома — область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Каждая электронная оболочка может иметь определенное максимальное число электронов.
Электронная плотность – вероятность нахождения электрона в конкретной точке пространства в атоме.
Электроотрицательность (χ) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле притягивать к себе общие электронные пары.
Энергия ионизации Е и, - энергия, необходимая для удаления электрона из атома, иона, радикала или молекулы в газовой фазе при Т = 0 К без передачи освобожденному электрону кинетической энергии. Выражают Е и в Дж, кДж, или электрон-вольтах (эВ). 1эВ – энергия, которую приобретает электрон в ускоряющем электрическом поле с разностью потенциалов 1В (1эВ=96,5 кДж/моль).
Эндотермические реакции — химические реакции, сопровождающиеся поглощением теплоты (напр., разложение СаСО3 на СаО и СО2).
Энтальпия, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Энтропия — сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
 2020-10-10
2020-10-10 543
543








