Карбоновые кислоты содержат функциональную группу СООН, связанную с радикалом или атомом водорода.
В молекулах карбоновых кислот можно выделить ряд реакционных центров:

· ОН-кислотный центр, за счет которого карбоновые кислоты проявляют кислотные свойства в реакциях с основаниями;
· электрофильный центр – атом углерода карбоксильной группы, при участии которого карбоновые кислоты и их функциональные производные вступают в реакции нуклеофильного замещения;
· основный центр – оксогруппа со своей неподеленной парой электронов, которая протонируется на стадии катализа в реакциях нуклеофильного замещения;
· СН-кислотный центр, возникающий у α-атома углерода за счет индуктивного эффекта карбоксильной группы.
Кислотный характер карбоновых кислот ярко выражен. Это объясняется взаимным влиянием атомов в карбоксильной группе: в ней электронная плотность смещена в сторону наиболее электроноакцепторного атома кислорода карбонильной группы. Это приводит к ослаблению связи между кислородом и водородом в гидроксильной группе и легкости отщепления атома водорода от гидроксила в виде протона (Н+).
Появление пониженной электронной плотности (δ+) на углеродном атоме карбоксила приводит также к стягиванию σ-электронов соседней связи С-С к карбоксильной группе и появлению пониженной электронной плотности δ'+ на α-углеродном атоме кислоты.
Кислотные свойства
В водных растворах они слабо диссоциированы, кислая среда обнаруживается с помощью индикаторов. При взаимодействии с основаниями, карбонатами, гидрокарбонатами и аммиаком карбоновые кислоты образуют соли:
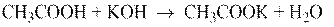
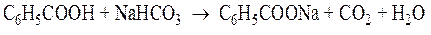
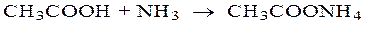
Дикарбоновые кислоты содержат две карбоксильные группы, поэтому они образуют два ряда солей – кислые и средние.
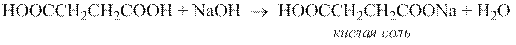
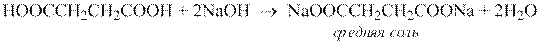
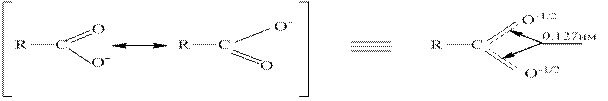
Более сильные кислотные свойства карбоновых кислот по сравнению с другими ОН-кислотами Бренстеда (спиртами и большинством фенолов) объясняется тем, что атомы кислорода и углерод в карбоксильной группе стабилизированы за счет сопряжения.
В анионе происходит полная делокализация π-электронной плотности, вследствие чего отрицательный заряд поровну распределяется между двумя атомами кислорода:
Строение радикала влияет на кислотные свойства карбоновых кислот. Электронодонорные заместители снижают кислотность.
Ненасыщенные и ароматические кислоты обладают большей кислотностью, чем насыщенные алифатические. Ароматические кислоты с заместителем в орто -положении более сильные, чем мета - и пара -изомеры. Электроноакцепторные заместители усиливают кислотность.
Замещенные карбоновые кислоты различаются по своей силе. Все моно-, ди- и тригалогензамещенные производные уксусной кислоты превосходят уксусную кислоту по величине константы диссоциации. Константа диссоциации трифторуксусной кислоты ~ в 50000 раз больше константы диссоциации уксусной кислоты.
Изменение кислотности карбоновых кислот основывается на индуктивном эффекте заместителей. Заместители, обладающие отрицательным индуктивным эффектом (- Iэф), стабилизируют карбоксилат-анион, что непосредственно отражается на значении р Ка соответствующих кислот. Вследствие затухания индуктивного эффекта второй карбоксильной группы кислотные свойства дикарбоновых кислот (по первой ступени диссоциации) уменьшаются по мере удаления карбоксильных групп друг от друга.
 2020-10-11
2020-10-11 173
173








